
【題目】三氯化六氨合鈷[Co(NH3)6]Cl3 是橙黃色、微溶于水的配合物,是合成其它一些含鈷配合物的原料。下圖是某科研小組以含鈷廢料(含少量Fe、Al 等雜質)制取[Co(NH3)6]Cl3 的工藝流程:
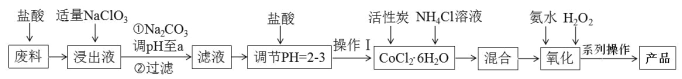
回答下列問題:
(1)寫出加“適量NaClO3”發生反應的離子方程式______________。
(2)“加Na2CO3 調pH至a”會生成兩種沉淀,分別為_______________________(填化學式)。
(3)操作Ⅰ的步驟包括_____________________________、冷卻結晶、減壓過濾。
(4)流程中NH4Cl除作反應物外,還可防止加氨水時c(OH-) 過大,其原理是_________________。
(5)“氧化”步驟,甲同學認為應先加入氨水再加入H2O2,乙同學認為試劑添加順序對產物無影響。你認為___________(填“甲”或“乙”)同學觀點正確,理由是_________________________________。寫出該步驟的化學方程式:________________________________
(6)通過碘量法可測定產品中鈷的含量。將 [Co(NH3)6]Cl3 轉化成Co3+后,加入過量KI 溶液,再用Na2S2O3標準液滴定(淀粉溶液做指示劑),反應原理:2Co3++2I-=2Co2++I2,I2+2S2O32-=2I-+S4O62-,實驗過程中,下列操作會導致所測鈷含量數值偏高的是_______。
a.用久置于空氣中的 KI 固體配制溶液
b.盛裝Na2S2O3標準液的堿式滴定管未潤洗
c.滴定結束后,發現滴定管內有氣泡
d.溶液藍色退去,立即讀數
【答案】6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O Fe(OH)3 和 Al(OH)3 HCl氛圍下蒸發濃縮 NH4Cl溶于水電離出NH4+會抑制后期加入的NH3·H2O的電離 甲 防止Co(OH)3的生成 H2O2+2CoCl2+2NH4Cl+10NH3·H2O=2Co(NH3)6Cl3↓+12H2O ab
【解析】
以含鈷廢料(含少量Fe、Al 等雜質)制取[Co(NH3)6]Cl3 ,用鹽酸溶解廢料,得到Co2+、Fe2+、Al3+的酸性溶液,加入適量的NaClO3將亞鐵離子氧化為鐵離子,再加入碳酸鈉調節pH,沉淀鋁離子、鐵離子為氫氧化鋁和氫氧化鐵,過濾,得到濾液,向含有Co2+的溶液中加入鹽酸調節pH=2-3,加入活性炭和氯化銨溶液得到CoCl2 6H2O,再依次加入氨水和過氧化氫,發生反應H2O2+2CoCl2+2NH4Cl+10NH3·H2O=2Co(NH3)6Cl3↓+12H2O,再將沉淀在氯化氫分為下蒸發濃縮,冷卻結晶,減壓過濾得到產品,據此分析作答。
(1)加適量NaClO3的目的是將亞鐵離子氧化為鐵離子,發生的離子反應為6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(2)加入碳酸鈉調節pH,沉淀鋁離子和鐵離子,轉化為Fe(OH)3 和 Al(OH)3;
(3)微粒防止產品水解,故應在HCl氛圍下蒸發濃縮;
(4)流程中氯化銨除作為反應物外,NH4Cl溶于水電離出NH4+會抑制后期加入的NH3·H2O的電離,可防止加氨水時氫氧根離子濃度過大;
(5)若先加入過氧化氫,將鈷元素氧化到Co3+,后加入氨水,會生成氫氧化鈷,不利于產品的生成,故甲同學正確,先加入氨水再加入過氧化氫,可防止Co(OH)3的生成,此時的反應為H2O2+2CoCl2+2NH4Cl+10NH3·H2O=2Co(NH3)6Cl3↓+12H2O;
(6) a.用久置于空氣中的 KI 固體配制溶液,碘化鉀部分被氧化為碘單質,滴定時消耗的硫代硫酸鈉標準增多,測定結果偏高,故正確;
b.盛裝Na2S2O3標準液的堿式滴定管未潤洗,則標準也被稀釋,滴定時消耗的硫代硫酸鈉標準也體積增多,測定結果偏高,故正確;
c.滴定結束后,發現滴定管內有氣泡,氣泡占體積,則消耗的硫代硫酸鈉標準液體積讀數偏小,測定結果偏低,故錯誤;
d.溶液藍色退去,立即讀數,此時溶液混合不均,碘單質并未完全被標準液反應完全,導致消耗的標準液減少,測定結果偏低,故錯誤。故選ab。


 小學數學口算題卡脫口而出系列答案
小學數學口算題卡脫口而出系列答案 優秀生應用題卡口算天天練系列答案
優秀生應用題卡口算天天練系列答案 浙江之星課時優化作業系列答案
浙江之星課時優化作業系列答案科目:高中化學 來源: 題型:
【題目】一種芳綸纖維的拉伸強度比鋼絲還高,廣泛用作防護材料。其結構片段如下圖
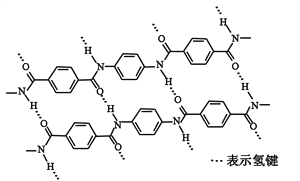
下列關于該高分子的說法正確的是
A. 完全水解產物的單個分子中,苯環上的氫原子具有不同的化學環境
B. 完全水解產物的單個分子中,含有官能團―COOH或―NH2
C. 氫鍵對該高分子的性能沒有影響
D. 結構簡式為:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列敘述正確的是( )
A. 1 mol鐵在一定條件下分別和氧氣、氯氣、硫完全反應轉移電子數都為2NA
B. 30 g葡萄糖和冰醋酸的混合物中含有的氫原子數為4NA
C. 12 g石墨烯(單層石墨)中含有六元環的個數為2NA
D. 2.1 g DTO中含有的質子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤粉中的氮元素在使用過程中的轉化關系如圖所示:

(1)②中NH3參與反應的化學方程式為_______。
(2)焦炭氮中有一種常見的含氮有機物吡啶(![]() ),其分子中相鄰的C和N原子相比,N原子吸引電子能力更___________(填“強”或“弱”),從原子結構角度解釋原因:________。
),其分子中相鄰的C和N原子相比,N原子吸引電子能力更___________(填“強”或“弱”),從原子結構角度解釋原因:________。
(3)工業合成氨是人工固氮的重要方法。2007年化學家格哈德·埃特爾證實了氫氣與氮氣在固體催化劑表面合成氨的反應過程,示意如圖:
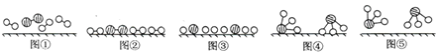
下列說法正確的是________(選填字母)。
a. 圖①表示N2、H2分子中均是單鍵
b. 圖②→圖③需要吸收能量
c. 該過程表示了化學變化中包含舊化學鍵的斷裂和新化學鍵的生成
(4)已知:N2(g) + O2(g) = 2NO(g) ΔH = a kJ·mol-1
N2(g) + 3H2(g) = 2NH3(g) ΔH = b kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH = c kJ·mol-1
反應后恢復至常溫常壓,①中NH3參與反應的熱化學方程式為________。
(5)用間接電化學法除去NO的過程,如圖所示:

①已知電解池的陰極室中溶液的pH在4~7之間,寫出陰極的電極反應式:________。
②用離子方程式表示吸收池中除去NO的原理:__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 1 mol H2O含有的質子數為10 mol
B. 0.5 mol SO42-含8 mol電子
C. 18 g水中含有的氧原子數為6.02×1022
D. 1 mol NaHSO4固體中含有的陰陽離子總數為3×6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可利用環己醇的氧化反應制備環己酮,反應原理和實驗裝置(部分夾持裝置略)如圖:
![]()
![]()
![]()
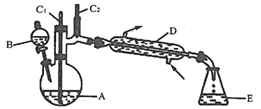
有關物質的物理性質見表。
物質 | 沸點(℃) | 密度(g·cm3,20℃) | 溶解性 |
環己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
環己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括號中的數據表示該有機物與水形成的具有固定組成的混合物的沸點。
實驗通過裝置B將酸性Na2Cr2O7溶液加到盛有10mL環己醇的A中,55~60℃進行反應。反應完成后,加入適量水,蒸餾,收集95~100℃的餾分,得到主要含環己酮粗品和水的混合物。
(1)裝置D的名稱為___________。
(2)酸性Na2Cr2O7溶液氧化環己醇反應的H<0,反應劇烈將導致體系溫度迅速上升,副反應增多。
①滴加酸性Na2Cr2O7溶液時反應的離子方程式__________;
②蒸餾不能分離環己酮和水的原因是____________。
(3)環己酮的提純需要經過以下一系列的操作:
a.蒸餾、除去乙醚后,收集151~156℃餾分
b.水層用乙醚(乙醚沸點34.6℃,易燃燒)萃取,萃取液并入有機層
c.過濾
d.往液體中加入NaCl固體至飽和,靜置,分液
e.加入無水MgSO4固體,除去有機物中少量的水
①上述提純步驟的正確順序是_____________;
②b中水層用乙醚萃取的目的是___________;
③上述操作c、d中使用的玻璃儀器除燒杯、錐形瓶、玻璃棒外,還需要的玻璃儀器有_______,操作d中,加入NaCl固體的作用是____________。
(4)恢復至室溫時,分離得到純產品體積為6mL,則環已酮的產率____________。(計算結果精確到0.1%)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向二元弱酸H2A溶液中滴加NaOH溶液,不同pH時,相關微粒的物質的量分數如圖所示,下列說法正確的是( )
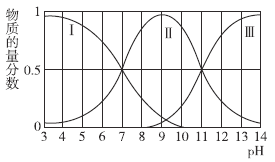
A.pH=7時,溶液中c(Na+)=c(H2A)
B.pH=9時,c(OH-)=c(H2A)+c(H+)
C.pH=3和pH=11時,溶液中水的電離程度完全相同
D.H2A的一級電離常數和二級電離常數相差2個數量級
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X(g)+3Y(g)![]() 2Z(g) ΔH=-akJ·mol-1,一定條件下,將1molX和3molY通入2L的恒容密閉容器中,反應10min,測得Y的物質的量為2.4mol。下列說法正確的是
2Z(g) ΔH=-akJ·mol-1,一定條件下,將1molX和3molY通入2L的恒容密閉容器中,反應10min,測得Y的物質的量為2.4mol。下列說法正確的是
A.10min內,Y的平均反應速率為0.03mol·L-1·s-1
B.第10min時,X的反應速率為0.01mol·L-1·min-1
C.10min內,消耗0.2molX,生成0.4molZ
D.10min內,X和Y反應放出的熱量為akJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NH4NO3的分解產物與溫度有關:
NH4NO3![]() NH3↑+HNO3↑①
NH3↑+HNO3↑①
NH4NO3![]() N2O↑+2H2O↑②
N2O↑+2H2O↑②
2NH4NO3![]() 2N2↑+O2↑+4X↑③
2N2↑+O2↑+4X↑③
4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑④
3N2↑+2NO2↑+8H2O↑④
下列說法錯誤的是
A.四個反應中有三個是氧化還原反應
B.反應②所得混合氣體的相對分子質量是26.7
C.反應③中X的化學式是H2O
D.反應④的氧化產物是N2,還原產物是NO2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com