
【題目】(1)某溫度下,純水中的c(H+)=2×10-7 mol/L,則此時c(OH-)=___。若溫度不變,滴入稀硫酸使c(H+)=5×10-6mol/L,則由水電離出的c(H+)為___。
(2)常溫下有一pH=12的NaOH溶液100mL,欲使它的pH降為11。
①如果加入蒸餾水,就加入___mL;
②如果加入pH=10的NaOH溶液,應加入___mL;
③如果加入0.008mol/L HCl溶液,應加入____mL。
(3)常溫下,濃度均為0.01 mol/L的兩瓶溶液鹽酸和氫氟酸,升高相同的溫度c(Cl-)/c(F-)的值____(填“變大”“變小”“不變”)。
【答案】2×10-7 mol/L 8×10-9 mol/L 900 1000 100 變小
【解析】
在純水中,不管是改變溫度還是加入電解質,水電離出的c(H+)、c(OH-)一定相等。
(1)某溫度下,純水中的c(H+)=2×10-7 mol/L,則此時c(OH-)=2×10-7 mol/L;若溫度不變,滴入稀硫酸使c(H+)=5×10-6mol/L,則由水電離出的c(H+) = c(OH-)溶液=![]() ,答案為:2×10-7 mol/L;8×10-9mol/L;
,答案為:2×10-7 mol/L;8×10-9mol/L;
(2)常溫下有一pH=12的NaOH溶液100mL,欲使它的pH降為11。
①如果加入蒸餾水,設其體積為xmL,則有![]() , x=900,答案為900;
, x=900,答案為900;
②如果加入pH=10的NaOH溶液,設其體積為ymL,則有![]() y=1000,答案為1000;
y=1000,答案為1000;
③如果加入0.008mol/L HCl溶液,設其體積為zmL,則有![]() z=100,答案為100;
z=100,答案為100;
(3)常溫下,濃度均為0.01 mol/L的兩瓶溶液鹽酸和氫氟酸,升高相同的溫度,鹽酸的電離程度不變(完全電離),而氫氟酸的電離度增大,c(F-)增大,所以c(Cl-)/c(F-)減小,答案為:減小。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】已知t ℃時AgCl的Ksp=4×10-10,在t ℃時,Ag2CrO4在水中的沉淀溶解平衡曲線如圖所示。下列說法錯誤的是( )
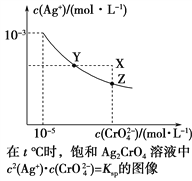
A. 在t ℃時,Ag2CrO4的Ksp為1×10-11
B. 在飽和溶液中加入K2CrO4(s)可使溶液由Y點到Z點
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常數K=6.25×107
(aq)平衡常數K=6.25×107
D. 在t ℃時,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組探究 Mg 與 NaHCO3 溶液反應的機理,做了如下探究。
實驗一:
實驗 A | 實驗 B | |
操作 | 在注射器中加入過量鎂片(擦去表面氧化膜), 吸入 15mL 飽和 NaHCO3 溶液。 | 在注射器中加入過量鎂片(擦去表面 氧化膜),吸入 15mL 蒸餾水。 |
現象 | 有氣體產生,20min 后注射器內壁和底部產生 大量白色沉淀 | 緩慢產生氣體 |
(1)寫出 B 中生成氣體的化學方程式_____。
實驗二:
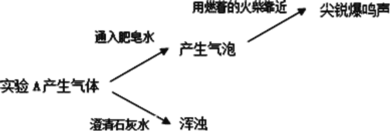
(2)實驗 A 產生的氣體有_____。
實驗三:分別取少量實驗 A 和 B 的上層清液于兩支試管中,各加入 2 滴 BaCl2 溶液,A 中立即產生白色沉淀,B 中無明顯現象。
(3)實驗三說明 Mg 與 NaHCO3 溶液反應產生了_____(填離子符號)。對 A 中白色固體的成分提出假設:
I.白色固體是 Mg(OH)2;II.白色固體是 MgCO3;III.白色固體是堿式碳酸鎂。
實驗四:
將 A 中白色沉淀過濾、洗滌后,取 0.1mol 加入 1mol/L 鹽酸 800mL 恰好完全反應,產生標況下的 CO2 氣體 6.72L。
(4)白色沉淀的主要成分為_____(寫化學式)。
(5)綜上所述,結合平衡移動原理解釋實驗 A 中產生現象的原因____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組為了證明二氧化硫和氯氣的漂白性,設計了如下圖所示的實驗裝置:
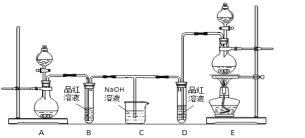
他們制備二氧化硫和氯氣所依據的原理分別是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(濃) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用來制取氯氣的裝置是______(填字母),反應中濃鹽酸所表現出________________性質。
(2)反應開始一段時間后,B、D試管中的品紅溶液均退色。停止通氣后,再給B、D兩個試管分別加熱____ (填" B”或“D")試管中無明顯現象。
(3)裝置C的作用是________________________;
(4)若裝置D中的品紅溶液換成紫色的石蕊溶液,則出現的現象是____________________________;
(5)該小組同學將兩種氣體混合后通入品紅溶液,一段時間后,品紅溶液幾乎不退色。查閱資料得知:兩種氣體按體積比1:1混合,再與水反應可生成兩種常見的酸,因而失去漂白作用,該反應的化學方程式是:________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了探究Cl2、SO2同時通入H2O中發生的反應,某校化學興趣小組同學設計了如圖所示的實驗裝置。

(1)該化學興趣小組的同學為制取Cl2、SO2氣體,現采用Na2SO3與70%的硫酸為原料制取SO2,采用MnO2和濃鹽酸(12 mol·L-1)為原料制取Cl2。在此實驗中,F儀器的作用是________;發生裝置B應選擇以下三種裝置中的________(填序號)。
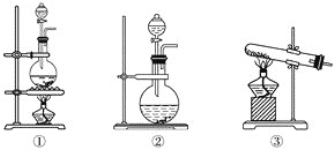
(2)D裝置中主要反應的離子方程式為____________________________________________________。
(3)為驗證通入D裝置中的氣體是Cl2過量還是SO2過量,興趣小組的同學準備了以下試劑:
①氯化鐵溶液 ②氯化亞鐵溶液 ③硫氰化鉀溶液 ④酸性高錳酸鉀溶液
若Cl2過量,取適量D中溶液滴加至盛有________(填一個序號,下同)試劑的試管內,再加入________試劑。發生的現象是_____________________________________________。
若SO2過量,取適量D中溶液滴加至盛有________試劑的試管內,發生的現象是________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標況下,一容積不變的密閉容器里充滿硫化氫和氧氣的混合氣體,點燃恰好完全反應后,恢復至原狀態,壓強變為原來的![]() ,計算原混合氣體的硫化氫和氧氣的體積比________。
,計算原混合氣體的硫化氫和氧氣的體積比________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原子序數為x的元素E在周期表中位于A、B、C、D四種元素中間(如圖所示),則A、B、C、D四種元素的原子序數之和不可能是(鑭系、錒系、0族元素除外)( )
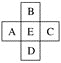
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】維綸(聚乙烯醇縮甲醛纖維)可用于生產服裝、繩索等。其合成路線如下:
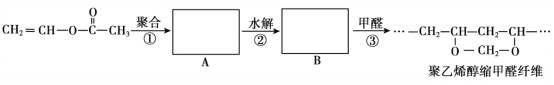
下列說法不正確的是
A.反應①是加聚反應
B.高分子A的鏈節中只含有一種官能團
C.通過質譜法測定高分子B的平均相對分子質量,可得其聚合度
D.反應③的化學方程式為:![]() +nHCHO→
+nHCHO→![]() +(2n-1)H2O
+(2n-1)H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現在含有生命元素硒(![]() )的保健品已經進入市場,已知硒與氧同族,與鉀同周期,則下列關于硒的敘述中正確的是( )
)的保健品已經進入市場,已知硒與氧同族,與鉀同周期,則下列關于硒的敘述中正確的是( )
A.硒單質在常溫下是固體
B.硒的氣態氫化物穩定性比![]() 強
強
C.硒是金屬元素
D.硒酸(![]() )的酸性比硫酸強
)的酸性比硫酸強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com