
【題目】某學習小組探究 Mg 與 NaHCO3 溶液反應的機理,做了如下探究。
實驗一:
實驗 A | 實驗 B | |
操作 | 在注射器中加入過量鎂片(擦去表面氧化膜), 吸入 15mL 飽和 NaHCO3 溶液。 | 在注射器中加入過量鎂片(擦去表面 氧化膜),吸入 15mL 蒸餾水。 |
現象 | 有氣體產生,20min 后注射器內壁和底部產生 大量白色沉淀 | 緩慢產生氣體 |
(1)寫出 B 中生成氣體的化學方程式_____。
實驗二:
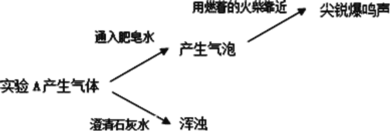
(2)實驗 A 產生的氣體有_____。
實驗三:分別取少量實驗 A 和 B 的上層清液于兩支試管中,各加入 2 滴 BaCl2 溶液,A 中立即產生白色沉淀,B 中無明顯現象。
(3)實驗三說明 Mg 與 NaHCO3 溶液反應產生了_____(填離子符號)。對 A 中白色固體的成分提出假設:
I.白色固體是 Mg(OH)2;II.白色固體是 MgCO3;III.白色固體是堿式碳酸鎂。
實驗四:
將 A 中白色沉淀過濾、洗滌后,取 0.1mol 加入 1mol/L 鹽酸 800mL 恰好完全反應,產生標況下的 CO2 氣體 6.72L。
(4)白色沉淀的主要成分為_____(寫化學式)。
(5)綜上所述,結合平衡移動原理解釋實驗 A 中產生現象的原因____________________________。
【答案】Mg+2H2O=Mg(OH)2+H2↑ CO2 CO32- Mg4(OH)2(CO3)3 在碳酸氫鈉溶液中存在著電離平衡HCO3- H++ CO32-和水解平衡HCO3- + H2OH2CO3+OH-,Mg與H+反應生成Mg2+和H2促進了電離平衡正向移動,Mg2+和CO32-、OH-反應生成Mg4(OH)2(CO3)3沉淀,減少了CO32-、OH-的濃度,不僅促進了電離平衡正向移動,也促進了水解平衡正向移動,H2CO3的濃度增大并分解為CO2。
【解析】
該學習小組探究 Mg 與NaHCO3溶液反應的機理,根據產生的氣體具有可燃性可知氣體中有H2;根據產生的氣體能使澄清的石灰水變渾濁,可以確定其中有CO2;根據實驗三可知反應后的溶液中有CO32-;根據定量實驗的數據可以確定沉淀的化學式;根據平衡移動原理可說明該反應的機理。
(1)鎂在常溫下可以與水緩慢反應生成氫氧化鎂和氫氣,所以B 中生成氣體的化學方程式為Mg+2H2O=Mg(OH)2+H2↑。
(2)實驗 A 產生的氣體能使澄清的石灰水變渾濁,說明A中產生的氣體中還有CO2。
(3)分別取少量實驗 A 和 B 的上層清液于兩支試管中,各加入 2 滴BaCl2溶液,A 中立即產生白色沉淀,該沉淀可能為碳酸鋇,說明 Mg 與NaHCO3溶液反應產生了CO32-。
(4)取 0.1mol 白色沉淀加入 1mol/L 鹽酸 800mL 恰好完全反應,根據Cl-守恒可知n(MgCl2)=0.4mol;根據產生標況下的CO2氣體 6.72L,可知CO2氣體的物質的量為0.3mol,則n(CO32-)=0.3mol;根據電荷守恒可知,n(OH-)=0.2mol。因此,白色沉淀的主要成分為Mg4(OH)2(CO3)3。
(5)在碳酸氫鈉溶液中存在著電離平衡HCO3- H++ CO32-和水解平衡HCO3- + H2OH2CO3+OH-。Mg與H+反應生成Mg2+和H2促進了電離平衡正向移動,Mg2+和CO32-、OH-反應生成Mg4(OH)2(CO3)3沉淀,減少了CO32-、OH-的濃度,不僅促進了電離平衡正向移動,也促進了水解平衡正向移動,H2CO3的濃度增大并分解為CO2。綜上所述,實驗 A 中產生現象的原因是:在碳酸氫鈉溶液中存在著電離平衡HCO3- H++ CO32-和水解平衡HCO3- + H2OH2CO3+OH-,Mg與H+反應生成Mg2+和H2促進了電離平衡正向移動;Mg2+和CO32-、OH-反應生成Mg4(OH)2(CO3)3沉淀,減少了CO32-和OH-的濃度,不僅促進了電離平衡正向移動,也促進了水解平衡正向移動,H2CO3的濃度增大并分解為CO2。


科目:高中化學 來源: 題型:
【題目】寫出下列反應的化學方程式,并分別用雙線橋法和單線橋法表示電子轉移的方向和數目。
(1)用氫氣還原氧化銅。__、__。
(2)加熱氯酸鉀分解制取氧氣。__、__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)亞硝酰氯(ClNO)是有機合成中常用試劑,已知:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,一定溫度下,將2 molNO與2 molCl2置于2L密閉容器中發生反應。
2ClNO(g) △H<0,一定溫度下,將2 molNO與2 molCl2置于2L密閉容器中發生反應。
①下列可判斷反應達平衡狀態的是___________(填序號字母)。
A. 混合氣體的平均相對分子質量不變 B. 混合氣體密度保持不變
C. NO和Cl2的物質的量之比保持不變 D. 每消耗1 moI NO同時生成1molClNO
②為了加快化學反應速率,同時提高NO的轉化率,其他條件不變時,可采取的措施有_________(填選項序號字母)。
A. 升高溫度 B. 縮小容器體積 C. 再充入Cl2氣體 D. 使用合適的催化劑
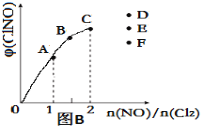
③一定條件下在恒溫恒容的密閉容器中,按一定比例充入NO(g)和Cl2(g),平衡時ClNO的體積分數隨n(NO)/n(Cl2)的變化圖像如圖(B)所示,當n(NO)/n(Cl2)=2.5時,達到平衡狀態,ClNO的體積分數可能是下圖中D、E、F三點中的________點。
(2) 在體積為10 L的密閉容器中充入3 mol NO和2 mol Cl2,在不同溫度下發生反應2NO(g)+Cl2(g)![]() 2ClNO(g),ClNO的百分含量隨時間的變化如圖所示。已知T1>T2>T3。
2ClNO(g),ClNO的百分含量隨時間的變化如圖所示。已知T1>T2>T3。
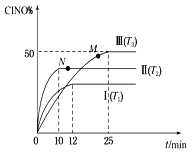
①與實驗Ⅰ相比,實驗Ⅱ除溫度不同外,還改變的條件是__________________。
②實驗Ⅲ反應至25 min達到平衡,用NO物質的濃度變化表示的反應速率為__________________。達到平衡時,若實驗Ⅲ達到平衡時的熱量變化為Q kJ,則該反應的熱化學方程式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同一主族的X,Y,Z三種元素,已知其最高價含氧酸的鈉鹽溶液,等物質的量濃度時,溶液的pH大小為![]() ,則下列推斷正確的是
,則下列推斷正確的是
A.元素的非金屬性強弱![]() B.相對原子質量
B.相對原子質量![]()
C.陰離子的還原性![]() D.氣態氫化物穩定性
D.氣態氫化物穩定性![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃銅礦(CuFeS2)是制取銅及其化合物的主要原料之一,還可制備硫和鐵的化合物。
(1)冶煉銅的反應為8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合價為+2,反應中被還原的元素是________(填元素符號)。
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合價為+2,反應中被還原的元素是________(填元素符號)。
(2)上述冶煉過程產生大量SO2。下列處理方案中合理的是________(填代號)。
a.高空排放 b.用于制備硫酸
c.用純堿溶液吸收制Na2SO3 d.用濃硫酸吸收
(3)利用黃銅礦冶煉銅產生的爐渣(含Fe2O3、FeO、SiO2、Al2O3)可制備Fe2O3。方法為:
①用稀鹽酸浸取爐渣,過濾。
②濾液先氧化,再加入過量NaOH溶液,過濾,將沉淀洗滌、干燥、煅燒得Fe2O3。
根據以上信息回答下列問題:
a.除去Al3+的離子方程式是_____________________________________________________。
b.選用提供的試劑,設計實驗驗證爐渣中含有FeO。
提供的試劑:稀鹽酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所選試劑為________。證明爐渣中含有FeO的實驗現象為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年10月1曰,在慶祝中華人民共和國成立70周年的閱兵儀式上,最后亮相的DF-31A洲際戰略導彈是我國大國地位、國防實力的顯著標志。其制作材料中包含了Fe、Cr、Ni、C等多種元素。回答下列問題:
(1)基態Cr原子的價電子排布式為___。
(2)實驗室常用KSCN溶液、苯酚(![]() )檢驗Fe3+。
)檢驗Fe3+。
①第一電離能:N___O(填“>”或“<”)。
②1mol苯酚中含有的σ數目為___。
③苯酚中的氧原子和碳原子均采用相同的雜化方式,其類型為___。
④從結構的角度分析苯酚的酚羥基有弱酸性的原因為___。
(3)碳的一種同素異形體的晶體可采取非最密堆積,然后在空隙中插入金屬離子獲得超導體。如圖為一種超導體的面心立方晶胞,C60分子占據頂點和面心處,K+占據的是C60分子圍成的___空隙和___空隙(填幾何空間構型);若C60分子的坐標參數分別為A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,則距離A位置最近的陽離子的原子坐標參數為___。
),C(1,1,1)等,則距離A位置最近的陽離子的原子坐標參數為___。
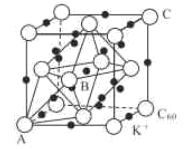
(4)Ni可以形成多種氧化物,其中一種NiaO晶體晶胞結構為NaCl型,由于晶體缺陷,a的值為0.88,且晶體中的Ni分別為Ni2+、Ni3+,則晶體Ni2與Ni3+產的最簡整數比為___,晶胞參數為428pm,則晶體密度為___gcm-3(NA表示阿伏加德羅常數的值,列出表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】五氧化二釩常用作化學工業中的催化劑,廣泛用于冶金、化工生產。一種以釩渣(主要含有V2O3,還有少量FeO、Al2O3、SiO2等)為原料生產V2O5的工藝流程如圖:

已知:VO![]() +H2O
+H2O![]() VO
VO![]() +2H+
+2H+
(1)“焙燒”時,V2O3轉化為NaVO3的化學方程式是___。
(2)濾渣1為___(填化學式),“酸浸”后,調pH=7.6,除了得到沉淀Fe(OH)3、___,另一個目的是___。
(3)“沉釩”得到偏釩酸銨(NH4VO3)的離子方程式是___。圖1是沉釩率隨溫度的變化曲線,溫度高于80℃,沉釩率下降,其可能原因是___。
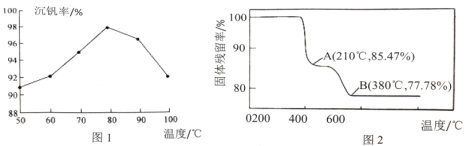
(4)在“煅燒”過程中,固體殘留率(剩余固體質量/原始固體質量x100%)隨溫度變化的曲線如圖2所示。NH4VO3分解過程中,先后失去的物質分別是___、___。(填化學式)
(5)金礬液流電池的電解質溶液為VOSO4溶液,電池的工作原理為VO2++V2++2H+![]() VO2++H2O+V3+,電池充電時,陽極的電極反應式為___。
VO2++H2O+V3+,電池充電時,陽極的電極反應式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某溫度下,純水中的c(H+)=2×10-7 mol/L,則此時c(OH-)=___。若溫度不變,滴入稀硫酸使c(H+)=5×10-6mol/L,則由水電離出的c(H+)為___。
(2)常溫下有一pH=12的NaOH溶液100mL,欲使它的pH降為11。
①如果加入蒸餾水,就加入___mL;
②如果加入pH=10的NaOH溶液,應加入___mL;
③如果加入0.008mol/L HCl溶液,應加入____mL。
(3)常溫下,濃度均為0.01 mol/L的兩瓶溶液鹽酸和氫氟酸,升高相同的溫度c(Cl-)/c(F-)的值____(填“變大”“變小”“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,BaSO4在水中的沉淀溶解平衡曲線如圖所示.下列說法正確的是

A. 加入Na2SO4可使溶液由a點變到b點
B. 通過蒸發可以使溶液由d點變到c點
C. d點無BaSO4沉淀生成
D. a點對應的Ksp大于c點對應的Ksp
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com