
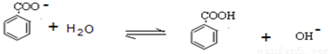 .
.
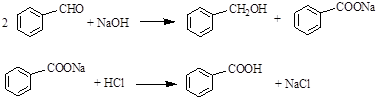
分析 (1)萃取時用到的玻璃儀器除了燒杯、玻璃棒外,還需分液漏斗;
(2)②中合并三次萃取后的萃取液中含有產品苯甲醇、未反應的苯甲醛,及少量從水層轉移過來的苯甲酸,碳酸鈉溶液洗滌是為了除去醚層中極少量的苯甲酸,苯甲酸是苯甲酸鈉水解生成的;用水洗去可溶性雜質,飽和亞硫酸氫鈉溶液洗滌目的是洗去未反應的苯甲醛;
(3)無水硫酸鎂是干燥劑;題目信息中,乙醚易揮發,與空氣混合易發生爆炸,蒸餾時應防止揮發到空氣中;題目信息中,苯甲醇沸點為205.3℃,收集205℃~206℃的餾分得產品應是苯甲醇;
(4)題目信息中,乙醚沸點34.6℃,蒸餾除乙醚的過程中采用的加熱方式應用水浴加熱;石蠟油沸點高于250℃,蒸餾得產品A,應控制溫度高于苯甲醇的沸點,用石蠟油油浴加熱;
(5)實驗步驟②中保留待用水層中主要含有苯甲酸鈉,慢慢地加入到盛有濃鹽酸和水的混合物中,析出白色固體為苯甲酸,由于苯甲酸溶解度受溫度影響較大,可以利用重結晶方法進行提純.
解答 解:(1)萃取時用到的玻璃儀器除了燒杯、玻璃棒外,還需分液漏斗,故答案為:分液漏斗;
(2)②中合并三次萃取后的萃取液中含有產品苯甲醇、未反應的苯甲醛,及少量從水層轉移過來的苯甲酸,碳酸鈉溶液洗滌是為了除去醚層中極少量的苯甲酸,苯甲酸是苯甲酸鈉水解生成的,反應離子方程式為: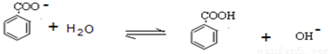 ;用水洗去可溶性雜質,故飽和亞硫酸氫鈉溶液洗滌目的是洗去未反應的苯甲醛,
;用水洗去可溶性雜質,故飽和亞硫酸氫鈉溶液洗滌目的是洗去未反應的苯甲醛,
故答案為:未反應完的苯甲醛;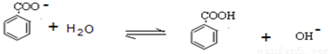 ;
;
(3)加無水硫酸鎂的作用是吸收水分,起到干燥的作用;
題目信息中,乙醚易揮發,與空氣混合易發生爆炸,蒸餾時錐形瓶上要加塞防止揮發到空氣中;
題目信息中,苯甲醇沸點為205.3℃,收集205℃~206℃的餾分得產品應是苯甲醇,
故答案為:吸收水分;防止乙醚揮發與空氣混合,發生爆炸;苯甲醇;
(4)題目信息中,乙醚沸點34.6℃,蒸餾除乙醚的過程中采用的加熱方式應用水浴加熱;石蠟油沸點高于250℃,蒸餾得產品A,應控制溫度高于苯甲醇的沸點,用石蠟油油浴加熱,
故答案為:水浴加熱;石蠟油油浴加熱;
(5)實驗步驟②中保留待用水層中主要含有苯甲酸鈉,慢慢地加入到盛有30mL濃鹽酸和30mL水的混合物中,同時用玻璃棒攪拌,析出白色固體為苯甲酸,冷卻,抽濾,得到粗產品,由于苯甲酸溶解度受溫度影響較大,可以利用重結晶方法進行提純,
故答案為:重結晶.
點評 本題考查有機物制備實驗,側重考查學生對原理及操作的分析評價、物質的分離提純等,關鍵是充分利用題目給予的信息進行解答,較好的考查學生分析推理能力、知識遷移運用能力,題目難度中等.


 期末好成績系列答案
期末好成績系列答案 99加1領先期末特訓卷系列答案
99加1領先期末特訓卷系列答案 百強名校期末沖刺100分系列答案
百強名校期末沖刺100分系列答案 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 若正反應是吸熱反應,則A為非氣態 | B. | 若正反應是吸熱反應,則A為氣態 | ||
| C. | 若正反應是放熱反應,則A為氣態 | D. | 若正反應是放熱反應,則A為非氣態 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4HCO3溶于過量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氯化鐵溶液腐蝕印刷線路板上的銅:Fe3++Cu═Fe2++Cu2+ | |
| D. | 向亞硫酸鋇固體中加入稀硝酸:3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| Fe3+ | Cu2+ | Fe2+ | |
| 開始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 凡金屬元素與非金屬元素之間都形成離子鍵 | |
| B. | 形成離子鍵的微粒必須是金屬陽離子與陰離子 | |
| C. | 含有離子鍵的化合物中,也可能還含有共價鍵 | |
| D. | 非金屬元素形成的化合物一定不存在離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 滴加甲基橙試劑顯紅色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水電離的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com