
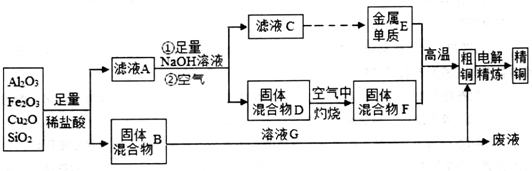
分析 某銅礦石的成分中含有Cu2O,還含有少量的Al2O3、Fe203和Si02,加入足量稀硫酸過濾,Cu2O溶于酸反應生成銅和銅鹽,所以固體混合物B為Cu、Si02,濾液A中為亞鐵離子、鋁離子和銅離子,加入足量氫氧化鈉溶液過濾得到固體混合物D為氫氧化銅、氫氧化鐵,濾液為C為AlO2-離子,通入二氧化碳生成氫氧化鋁沉淀,氫氧化鋁分解得到氧化鋁,電解熔融氧化鋁得到金屬E為Al,固體混合物D空氣中加熱灼燒得到氧化鐵和氧化銅,和鋁發生鋁熱反應得到粗銅,含有鐵雜質,粗銅精煉得到精銅;固體混合物B中加足量的G為NaOH溶液,過濾,濾渣為Cu,濾液為硅酸鈉溶液;結合物質的性質分析解答.
解答 解:某銅礦石的成分中含有Cu2O,還含有少量的Al2O3、Fe203和Si02,加入足量稀硫酸過濾,Cu2O溶于酸反應生成銅和銅鹽,所以固體混合物B為Cu、Si02,濾液A中為亞鐵離子、鋁離子和銅離子,加入足量氫氧化鈉溶液過濾得到固體混合物D為氫氧化銅、氫氧化鐵,濾液為C為AlO2-離子,通入二氧化碳生成氫氧化鋁沉淀,氫氧化鋁分解得到氧化鋁,電解熔融氧化鋁得到金屬E為Al,固體混合物D空氣中加熱灼燒得到氧化鐵和氧化銅,和鋁發生鋁熱反應得到粗銅,含有鐵雜質,粗銅精煉得到精銅;固體混合物B中加足量的G為NaOH溶液,過濾,濾渣為Cu,濾液為硅酸鈉溶液,
(1)Cu2O溶于酸反應生成銅和銅鹽,銅和鐵離子反應生成亞鐵離子,所以濾液A中為亞鐵離子,生成離子的離子方程式為:Cu+2Fe3+=2Fe2++Cu2+,檢驗亞鐵離子方法為:先加KSCN溶液,若不變色,再加氯水,變紅色,說明含有亞鐵離子;
故答案為:Fe2+,Cu+2Fe3+=2Fe2++Cu2+,硫氰化鉀溶液和氯水;
(2)金屬E與固體F發生的某一反應可用于焊接鋼軌,是金屬Al與氧化鐵和氧化銅發生置換反應生成金屬單質,該反應的化學方程式為2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$Al2O3+2Fe,在實驗室中完成此實驗還需要的試劑是引發劑氯酸鉀和鎂條,鎂條點燃后引發氯酸鉀分解生成氧氣促進燃燒反應進行放出大量的熱量,選ac,
故答案為:2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$Al2O3+2Fe,ac;
(3)固體混合物D空氣中加熱灼燒得到氧化鐵和氧化銅,冷卻至室溫后稱重,重復多次,直至連續兩次測定的實驗結果相同或質量相差小于0.1g,灼燒時必須用到的實驗儀器是坩堝中加熱灼燒,
故答案為:灼燒,冷卻至室溫后稱重,重復多次,坩堝;
(4)溶液G為氫氧化鈉溶液與固體混合物B為Cu、Si02 ,其中二氧化硅是酸性氧化物和氫氧化鈉溶液反應生成硅酸鈉和水,反應的離子反應方程式為:SiO2+2OH-=SiO32-+H2O,
故答案為:SiO2+2OH-=SiO32-+H2O;
(5)將Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化鈉、二氧化碳和一種綠色的不溶于水的鹽(不含結晶水),Cu2+和CO32-生成CuCO3沉淀,離子方程式為:Cu2++CO32-=CuCO3↓;Cu2+和CO32-和水發生雙水解反應生成Cu(OH)2沉淀和二氧化碳,離子方程式為:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑;若生成Cu(OH)2和CuCO3的混合物生成堿式鹽,說明二者溶解度相近,既生成氫氧化銅也生成碳酸銅;該鹽受熱分解產生三種氧化物,則其化學式是Cu2(OH)2CO3或Cu(OH)2•CuCO3 ,
故答案為:Cu2(OH)2CO3或Cu(OH)2•CuCO3;
點評 本題考查了分離提純的方法和基本操作的綜合應用,題目涉及銅的單質及其化合物的性質及轉化、離子檢驗、化學方程式、氧化還原滴定等,涉及范圍較廣,綜合性較強,題目難度中等,側重于考查學生的分析能力和計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 已知Ka(HClO)>Ka2(H2CO3),則有:2ClO-+CO2(少量)+H2O═CO32-+2HClO | |
| C. | 金溶于王水生成AuCl4-離子和NO:Au+4H++4Cl-+NO3-═AuCl4-+NO↑+2H2O | |
| D. | 用NaClO溶液吸收過量的SO2:ClO-+SO2+H2O═HSO3-+HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X氣體 | Y溶液 | Z溶液 | 試管中現象 | |
| A | NO2 | 硫酸亞鐵 | H2O | 溶液顏色變黃 |
| B | CO2 | 氯化鋇溶液 | Ca(OH)2 | 白色沉淀 |
| C | SO2 | 紫色石蕊試液 | NaOH | 石蕊先變紅后褪色 |
| D | NH3 | AgNO3 | H2SO4 | 先有白色沉淀后溶解 |

| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如圖:
向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如圖:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
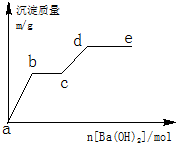 在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,產生的沉淀質量m與加入Ba(OH)2的物質的量n之間的關系如圖所示.
在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,產生的沉淀質量m與加入Ba(OH)2的物質的量n之間的關系如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
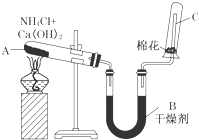 實驗室中用如圖所示裝置制取干燥的氨氣.
實驗室中用如圖所示裝置制取干燥的氨氣.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
圖示 | 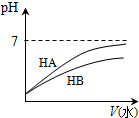 | 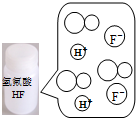 | 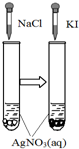 | 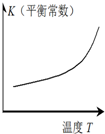 |
| 結論 | HB為弱酸 | HF為弱電解質 | 溶解度:AgI<AgCl | 正反應△H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | 只有③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 可用FeCl3溶液鑒別化合物I和II | |
| B. | 物質I在NaOH醇溶液中加熱可發生消去反應 | |
| C. | 物質II中所有原子可能位于同一平面內 | |
| D. | 物質III與足量H2加成所得產物分子中有2個手性碳原子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com