
分析 根據題意可知4.66g固體是硫酸鋇的質量,再計算出其中的鋇元素的質量,3.20g固體是Fe2O3的質量,計算出其中的鐵元素的質量,混合氧化物中氧元素的質量=12.52g-鋇元素的質量×2-鐵元素的質量×2,再用氧元素的質量除以12.52g,求化學式時根據各元素的質量除以相對原子質量,求出原子個數比來.
解答 解:(1)混合氧化物加入硫酸鉀溶液得到白色沉淀,硫酸鹽只有硫酸鋇不溶,所以4.66g固體是硫酸鋇的質量,則硫酸鋇中鋇元素的質量:4.66g×$\frac{137}{233}$×100%=2.74g,混合氧化物中加入氫氧化鈉得到紅褐色沉淀,紅褐色沉淀只有氫氧化鐵,所以3.20g是Fe2O3的質量,則Fe2O3中鐵元素的質量:3.20g×$\frac{112}{160}$×100%=2.24g,所以氧元素質量:12.52g-2.74g×2-2.24g×2=2.56g,所以氧元素質量分數為$\frac{2.56}{12.52}$×100%=20.45%,
故答案為:20.45%;
(2)由鋇元素質量為:2.74g,鐵元素質量為:2.24g,氧元素質量為:2.65g,所以鋇、鐵、氧原子個數比為:$\frac{2.74}{137}$:$\frac{2.24}{56}$:$\frac{2.56}{16}$=1:2:4 所以化學式為:BaFe204或BaO•Fe203,根據化合代數和為零,鐵為+3價,所以溶于足量稀鹽酸后溶液中的陽離子有鋇離子、鐵離子和氫離子,故答案為:鋇離子、鐵離子和氫離子.
點評 本題考查化學式的計算方法,解答本題的關鍵是要知道4.66g固體是硫酸鋇的質量,3.20g固體是氫氧化鐵的質量.


科目:高中化學 來源: 題型:解答題
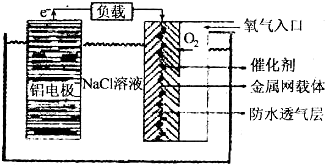
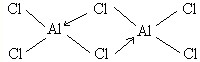 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 有電子轉移是氧化還原反應的本質,有元素化合價的變化是氧化還原反應的外觀表現 | |
| B. | 一種物質被氧化,必然有另一種物質被還原 | |
| C. | 被氧化的物質得到或偏向電子,被還原的物質失去或偏離電子 | |
| D. | 氧化劑在反應中被氧化,還原劑在反應中被還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題

| A. | a和d互為同素異形體 | B. | b和c互為同系物 | ||
| C. | a和d都能發生加成反應 | D. | 只有b和c能發生取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
; .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 以此電池為電源電解精煉銅,當有0.1 mol e-轉移時,有3.2 g銅溶解 | |
| B. | 若以甲烷為燃料氣時負極極反應式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 該電池使用過程中需補充Li2CO3和K2CO3 | |
| D. | 空氣極發生的電極反應式為O2+4e-+2CO2═2CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 現有常溫下的0.1mol/L小蘇打溶液,回答下列問題:
現有常溫下的0.1mol/L小蘇打溶液,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(OH-)>c(H+)>c(B+)>c(A-) | B. | c(B+)>c(A-)>c(H+)>c(OH-) | ||
| C. | c(B+)>c(A-)>c(OH-)>c(H+) | D. | c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com