
| A. | 在1 min時:c(SO3)+c(SO2)=1.0mol/L | |
| B. | 2 min 內:v(SO2)=0.25mol/(L•min) | |
| C. | 若再充入2mol SO3,達平衡時SO3%(質量分數)減小 | |
| D. | 反應條件相同,若起始時向反應容器中充入2mol SO3,平衡時反應吸熱0.75a kJ |
分析 A.2L的密閉容器中充人2mol SO2,硫元素的物質的量濃度=$\frac{2mol}{2L}$=1mol/L,依據元素守恒解答即可;
B.2min達到平衡狀態,反應放熱0.25a kJ,說明二氧化硫反應的物質的量為0.5mol,據此解答即可;
C.充入三氧化硫,三氧化硫的含量增多,據此解答即可;
D.起始時向反應容器中充入2mol SO3,相當于初始加入2mol SO2和1mol O2,據此解答即可.
解答 解:A.2L的密閉容器中充人2mol SO2,硫元素的物質的量濃度=$\frac{2mol}{2L}$=1mol/L,反應至任何時刻都有S元素守恒,即:c(SO3)+c(SO2)=1.0mol/L,故A正確;
B.2min達到平衡狀態,反應放熱0.25a kJ,故反應消耗的二氧化硫的物質的量=0.5mol,故速率=$\frac{\frac{0.5}{2}}{2}$mol/(L•min)=0.125mol/(L•min),故B錯誤;
C.再充入2mol SO3,達平衡時SO3%(質量分數)增大,故C錯誤;
D.起始時向反應容器中充入2mol SO3,相當于初始加入2mol SO2和1mol O2,與初始時加入2mol SO2和1mol O2,吸熱應大于0.75a,故D錯誤,
故選A.
點評 本題考查化學平衡的計算,題目難度中等,解答本題的關鍵是根據濃度關系計算平衡時各物質的物質的量,本題有利于調動學生的學習興趣和學習積極性,能夠提高學生靈活應用所學知識的能力.


 優加精卷系列答案
優加精卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下22.4 L的CCl4中含有NA個分子 | |
| B. | 1 mol Cl2溶于足量水中一定轉移NA個電子 | |
| C. | 18 g 18O2和18O3中一共含有NA個18O原子 | |
| D. | 1 mol•L-1的NaOH溶液中共含有NA個Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)聯氨(N2H4)是一種高能燃料.工業上可以利用氮氣和氫氣制備聯氨.
(1)聯氨(N2H4)是一種高能燃料.工業上可以利用氮氣和氫氣制備聯氨.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的摩爾質量就是1mol物質的質量 | |
| B. | 1mol水的質量、水的摩爾質量和水的相對分子質量在數值上都是18 | |
| C. | 各種物質的摩爾質量不可能相同 | |
| D. | 與物質的質量、物質的量多少無關,但與相對分子質量一樣都是物質的基本屬性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
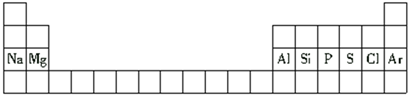
| A. | 鋁是第二周期元素 | |
| B. | 氯原子的半徑比硫原子的半徑小 | |
| C. | 氫氧化鈉的堿性比氫氧化鎂的堿性弱 | |
| D. | 硅原子的最外層電子數比磷原子的最外層電子數多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
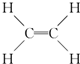 ,B中決定性質的重要官能團的名稱為羥基.
,B中決定性質的重要官能團的名稱為羥基.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液:K-、Na+、Cu2+、OH- | |
| B. | 由水電離出的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、Cl-、Br+- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 有較多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com