

分析 (1)由2NaNO2+4HI=2NO+I2+2NaI+2H2O可知,HI中I元素的化合價部分升高,部分不變,生成鹽(NaI),則HI體現酸性和還原性,N元素的化合價由+3降低為+2,I元素的化合價由-1升高為0,以此來解答;
(2)選擇試劑時要考慮:既能使NaNO2轉化又無二次污染;
(3)雙氧水體現氧化性說明雙氧水中元素化合價升高,體現還原性說明雙氧水中元素化合價降低;
(4)氧化劑的氧化性>氧化產物的氧化性>還原劑的氧化性;
(5)①根據氧化還原反應中氧化劑和還原劑的特點和性質來尋找反應物和生成物,然后結合化合價升降相等配平;
②根據所發生的反應來分析化合價的變化情況,進而得到轉移電子的數目.
解答 解:(1)N元素的化合價由+3降低為+2,I元素的化合價由-1升高為0,則雙線橋表示電子轉移的方向和數目為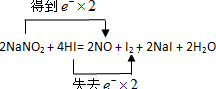 ,
,
故答案為: ;
;
(2)NaNO2→N2是被還原,必須加還原劑;N元素氧化性弱于O和Cl元素,故只能加NH4Cl作還原劑.方程式為NaNO2+NH4Cl═NaCl+N2↑+2H2O,亞硝酸鈉中氮得到3電子指向氮氣中的氮,氯化銨中氮失去3電子指向氮氣中的氮,
故答案為:B;
(3)A中無元素的化合價變化,B中Ag元素的化合價降低、雙氧水中O元素的化合價升高,B中過氧化氫具有還原性,C中雙氧水中氧元素化合價升高也降低,體現還原性和氧化性,只有D中雙氧水中氧元素化合價降低,說明雙氧水作氧化劑,體現了氧化性,故答案為:D;
(4)反應Ag2O+H2O2=2Ag+O2↑+H2O中,氧化銀做氧化劑,雙氧水作還原劑,則氧化性Ag2O>H2O2,反應3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,雙氧水做氧化劑,鉻酸鉀做氧化產物,則氧化性H2O2>K2CrO4,則氧化性順序為Ag2O>H2O2>K2CrO4,
故答案為:Ag2O>H2O2>K2CrO4.
(5)①該反應過程中,高錳酸根的氧化性和雙氧水的還原性導致二者間發生氧化還原反應,高錳酸根離子中錳元素從+7變為+2價,化合價降低5價,雙氧水中氧元素化合價從-1價變為0價,化合價至少升高2價,則高錳酸根離子的系數為2,雙氧水的系數為5,然后利用質量守恒配平可得該反應的離子方程式為:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案為:2MnO4-+5H2O2;
②上述反應中生成5mol氧氣轉移電子10mol,當反應中有6.72L(標準狀況)即0.3mol氧氣生成時,則轉移的電子為:10mol×$\frac{0.3mol}{5}$=0.6mol,
故答案為:0.6.
點評 本題考查了氧化還原反應的配平及綜合應用,題目難度中等,試題知識點較多、綜合性較強,充分考查學生的分析、理解能力及靈活應用能力,注意掌握氧化還原反應的配平方法,明確氧化劑、還原劑的概念及判斷方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 將5.85 g NaCl固體溶于1 L水中可配成0.1mol/L的NaCl 溶液 | |
| B. | 500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol | |
| C. | 把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L(忽略混合后體積變化) | |
| D. | 把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的質量分數是10% |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應是置換反應 | B. | 該反應中FeCl3作還原劑 | ||
| C. | 還原性:Cu>Fe2+ | D. | 氧化性:CuCl2>FeCl3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硅膠作袋裝食品的干燥劑沒有發生化學變化 | |
| B. | 碳纖維是一種新開發的材料,它屬于合成有機高分子化合物 | |
| C. | Al2O3用作耐火材料,Al(OH)3用作阻燃劑 | |
| D. | 小蘇打是治療胃酸過多的一種藥劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CuO→Cu(OH)2 | B. | CaCO3→CaCl2 | C. | Na2SO4→NaCl | D. | Mg(NO3)2→KNO3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com