
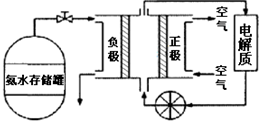
分析 (1)實驗室常用加熱氯化銨和氫氧化鈣的混合物制取氨氣;
(2)溶度積常數越小的越先產生沉淀;
(3)常溫下混合溶液呈中性,則c(H+)=c(OH-),根據電荷守恒c(H+)+c(NH4+)=c(OH-)+2c(SO42-)判斷硫酸根離子濃度;
(4)①氨氣是堿性氣體;
②空氣中的CO2能和氨水反應;
③生成的無毒氣體時N2,據此書寫化學方程式;正極發生氧化反應,氧氣在正極反應,注意時堿性環境.
解答 解:(1)實驗室常用加熱氯化銨和氫氧化鈣的混合物制取氨氣,反應方程式為2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O,
故答案為:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
(2)溶度積常數越小的物質越先沉淀,所以Fe(OH)3先沉淀,故答案為:Fe(OH)3;
(3)常溫下混合溶液呈中性,則c(H+)=c(OH-),根據電荷守恒c(H+)+c(NH4+)=c(OH-)+2c(SO42-),所以c(SO42-)=$\frac{a}{2}$mol/L,
故答案為:$\frac{a}{2}$mol/L;
(4)①氨氣是堿性氣體,所以電解液最好選擇堿性的,故答案為:堿性;
②空氣中的CO2能和氨水反應,所以,濾去的氣體是CO2,故答案為:CO2;
③正極發生氧化反應,氧氣在正極反應,注意時堿性環境,所以,正極的電極反應式為:O2+4e-+2H2O=4OH-,故答案為:O2+4e-+2H2O=4OH-.
點評 本題以氨氣為載體考查氨氣制取、難溶物溶解平衡、離子濃度計算、原電池原理等知識點,綜合性較強,明確原電池原理、鹽類水解原理、難溶物溶解平衡原理等即可解答,難點是電極反應式的書寫,要結合電解質溶液酸堿性書寫.


 浙大優學小學年級銜接捷徑浙江大學出版社系列答案
浙大優學小學年級銜接捷徑浙江大學出版社系列答案科目:高中化學 來源: 題型:解答題
 利用化學反應將存儲在物質內部的化學能轉化為電能,科學家設計出了原電池,從而為人類生產、生活提供能量.
利用化學反應將存儲在物質內部的化學能轉化為電能,科學家設計出了原電池,從而為人類生產、生活提供能量.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1160 | B. | 2308 | C. | 1441 | D. | 2320 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 有單質參加的反應,置換反應一定都屬于氧化還原反應 | |
| B. | 簡單非金屬陰離子只有還原性,而金屬陽離子只有氧化性 | |
| C. | 離子化合物在熔融態都能夠導電,共價化合物在熔融態都不導電 | |
| D. | 所有物質都有化學鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
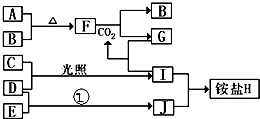 如圖是部分短周期元素的單質及其化合物(或其溶液)的轉化關系,已知B、C、D、E是非金屬單質且在常溫常壓下都是氣體;化合物G的焰色反應為黃色,化合物I和J通常狀況下呈氣態;反應①是化工生產中的一種固氮反應.
如圖是部分短周期元素的單質及其化合物(或其溶液)的轉化關系,已知B、C、D、E是非金屬單質且在常溫常壓下都是氣體;化合物G的焰色反應為黃色,化合物I和J通常狀況下呈氣態;反應①是化工生產中的一種固氮反應. .
. 2NH3的化學方程式.
2NH3的化學方程式.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com