
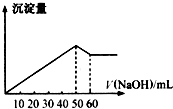
 (1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量與滴入NaOH溶液的體積關系如圖所示,則原混合液中Al2(SO4)3與MgSO4的物質的量濃度之比為
(1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量與滴入NaOH溶液的體積關系如圖所示,則原混合液中Al2(SO4)3與MgSO4的物質的量濃度之比為| 1.12L |
| 22.4L/moL |
| 11.2L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 2 |
| 1.12L |
| 22.4L/moL |
| 0.45mol |
| 1mol/L |
| 11.2L |
| 22.4L/mol |
| 16g |
| 0.5mol |
 ;
; ;
;

科目:高中化學 來源: 題型:
| A、Cl2 |
| B、鹽酸 |
| C、KMnO4 |
| D、FeCl3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、平衡常數隨溫度的改變而改變 | ||||||
| B、對于密閉容器中反應2SO2+O2?2SO3,2體積SO2與足量O2反應,能生成2體積SO3 | ||||||
| C、合成氨反應中使用催化劑,降低了反應所需要的活化能 | ||||||
D、反應H2(g)+I2(g)?2HI(g) 在450℃時,其平衡常數為49;則反應HI(g)?
|
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 用如圖裝置進行實驗,將A逐滴加入B中:
用如圖裝置進行實驗,將A逐滴加入B中:查看答案和解析>>
科目:高中化學 來源: 題型:
| ① | ② | ③ | ④ | ⑤ |
| 0.001mol?L-1 CH3COOH溶液 | pH=10 NaOH溶液 | 0.001mol?L-1 NaOH溶液 | pH=4 CH3COOH溶液 | pH=4 NH4Cl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、H2SO4是酸,因為H2SO4中含有氫元素 |
| B、氯化鈉晶體不能導電,所以氯化鈉不是電解質、 |
| C、2Na+2H2O═2NaOH+H2↑不是離子反應,因為反應中沒有離子參加 |
| D、8NH3+3Cl2═N2+6NH4Cl是氧化還原反應,因為反應中存在電子的轉移 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com