

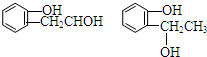 等.①遇FeCl3溶液顯紫色; ②在濃硫酸催化作用下能發生消去反應.
等.①遇FeCl3溶液顯紫色; ②在濃硫酸催化作用下能發生消去反應.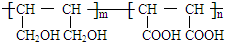 .
.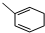 能與CH2=CHCOOH發生類似反應①的反應,生成化合物Ⅷ,寫出Ⅷ的一種結構簡式為
能與CH2=CHCOOH發生類似反應①的反應,生成化合物Ⅷ,寫出Ⅷ的一種結構簡式為 .
. 分析 Ⅰ與溴水發生1,4-加成所生產的Ⅳ為CH2BrCH=CHCH2Br,Ⅳ在氫氧化鈉水溶液、加熱條件下發生水解反應生成Ⅴ為HOCH2CH=CHCH2OH,V發生氧化反應生成Ⅱ,化合物Ⅱ與新制氫氧化銅溶液、酸化得到Ⅵ,則醛基轉化為羧基,則Ⅵ為HOOCCH=CHCOOH;
(3)化合物Ⅲ對應的同分異構體反應:①遇FeCl3溶液顯紫色,說明含有酚羥基;②在濃硫酸催化作用下能發生消去反應,含有醇羥基,較好Ⅲ的結構可知,側鏈為-OH、-CH2CH2OH,或-OH、-CH(CH3)OH,各
有鄰、間、對三種;
(4)化合物Ⅴ和化合物Ⅵ在一定條件下按物質的量m:n反應合成高分子化合物Ⅶ,且原子轉化率為100%,說明發生加聚反應;
(5) 能與CH2=CHCOOH發生類似反應①的反應,碳碳雙鍵均斷裂,
能與CH2=CHCOOH發生類似反應①的反應,碳碳雙鍵均斷裂, 的中間碳原子之間形成1個新的碳碳雙鍵,另外2個碳原子與CH2=CHCOOH中不飽和碳原子連接,有2種不同連接方式.
的中間碳原子之間形成1個新的碳碳雙鍵,另外2個碳原子與CH2=CHCOOH中不飽和碳原子連接,有2種不同連接方式.
解答 解:Ⅰ與溴水發生1,4-加成所生產的Ⅳ為CH2BrCH=CHCH2Br,Ⅳ在氫氧化鈉水溶液、加熱條件下發生水解反應生成Ⅴ為HOCH2CH=CHCH2OH,V發生氧化反應生成Ⅱ,化合物Ⅱ與新制氫氧化銅溶液、酸化得到Ⅵ,則醛基轉化為羧基,則Ⅵ為HOOCCH=CHCOOH.
(1)由結構簡式可知化合物Ⅲ的化學式為C8H10O2,碳碳雙鍵與醛基均氫氣發生加成反應,故l mol化合物Ⅲ最多能與3mol H2發生加成反應,
故答案為:C8H10O2;3;
(2))Ⅳ→Ⅴ是鹵代烴在氫氧化鈉水溶液、加熱條件下發生的水解反應,反應方程式為:BrCH2CH=CHCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaBr,
故答案為:BrCH2CH=CHCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaBr;
(3)化合物Ⅲ對應的同分異構體反應:①遇FeCl3溶液顯紫色,說明含有酚羥基;②在濃硫酸催化作用下能發生消去反應,含有醇羥基,較好Ⅲ的結構可知,側鏈為-OH、-CH2CH2OH,或-OH、-CH(CH3)OH,各
有鄰、間、對三種,共有6種,其中任意一種為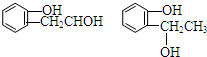 等,
等,
故答案為:6;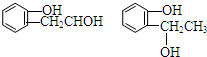 等;
等;
(4)化合物Ⅴ和化合物Ⅵ在一定條件下按物質的量m:n反應合成高分子化合物Ⅶ,且原子轉化率為100%,說明發生加聚反應,生成物結構簡式為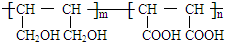 ,
,
故答案為: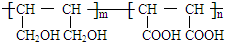 ;
;
(5) 能與CH2=CHCOOH發生類似反應①的反應,碳碳雙鍵均斷裂,
能與CH2=CHCOOH發生類似反應①的反應,碳碳雙鍵均斷裂, 的中間碳原子之間形成1個新的碳碳雙鍵,另外2個碳原子與CH2=CHCOOH中不飽和碳原子連接,有2種不同連接方式Ⅷ的一種結構簡式為:
的中間碳原子之間形成1個新的碳碳雙鍵,另外2個碳原子與CH2=CHCOOH中不飽和碳原子連接,有2種不同連接方式Ⅷ的一種結構簡式為: ,
,
故答案為: .
.
點評 本題考查有機物的推斷與合成、官能團結構與性質、同分異構體書寫等,需要學生熟練掌握官能團的結構、性質以及相互轉化,較好的考查學生自學能力、知識遷移運用能力,難度中等.


科目:高中化學 來源: 題型:解答題

| 加熱方式 | 產物元素組成 | 各元素的質量分數% | |
| Fe | O | ||
| 酒精燈 | Fe和O | 74.50 | 25.50 |
| 帶網罩酒精燈 | Fe和O | 76.48 | 23.52 |
| 酒精噴燈 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=1的溶液中:K+、Cr2O72-、C6H5OH、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Cu2+、Na+、Cl-、SO42- | |
| C. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、Cl-、NO3- | |
| D. | 0.1 mol/L Na2SiO3溶液中:K+、Cl-、NO3-、CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
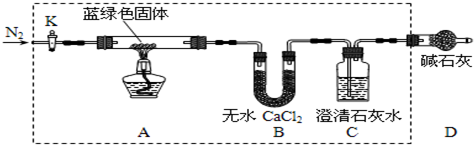
| 溶解度(S)/g | 溶度積(Ksp) | 摩爾質量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 化合物M的分子式為C14H15NO7 | |
| B. | 化合物M能使酸性KMnO4溶液褪色 | |
| C. | 化合物M能發生加成反應,不能發生消去反應 | |
| D. | 1mol在NaOH溶液中反應,最多消耗4molNaOH |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com