


科目:高中化學 來源:不詳 題型:單選題
| A.原子半徑大小:Al>Mg>Na |
| B.堿性強弱:KOH>NaOH>LiOH |
| C.氣態氫化物穩定性:HBr>HCl>HF |
| D.還原性強弱:F->Cl->Br->I- |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| A.極性鍵 | B.非極性鍵 | C.離子鍵 | D.配位鍵 E.氫鍵 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
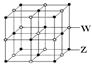
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
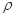 g·cm-3,阿伏加德羅常數為NA,
g·cm-3,阿伏加德羅常數為NA,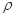 、NA的計算式表示)
、NA的計算式表示)查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
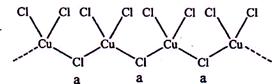
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
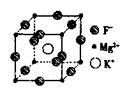
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
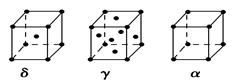
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com