
制備氮化鎂的裝置示意圖如下:

回答下列問題:
(1)檢查裝置氣密性的方法是_______________________________________,
a的名稱是________,b的名稱是________;
(2)寫出NaNO2和(NH4)2SO4反應制備氮氣的化學方程式______________________________;
(3)C的作用是______________________________________,
D的作用是_______________________________________,
是否可以把C和D的位置對調并說明理由____________________________;
(4)寫出E中發生反應的化學方程式______________________________;
(5)請用化學方法確定是否有氮化鎂生成,并檢驗是否含有未反應的鎂,寫出實驗操作及現象__________________________________________________
(1)微熱b,這時G中有氣泡冒出,停止加熱冷卻后,G中插在溶液里的玻璃管形成一段水柱,則氣密性良好 分液漏斗 圓底燒瓶
(2)2NaNO2+(NH4)2SO4 2N2↑+Na2SO4+4H2O
2N2↑+Na2SO4+4H2O
(3)除去氧氣及氮氧化物 除去水蒸氣 不能,對調后無法除去水蒸氣
(4)N2+3Mg Mg3N2
Mg3N2
(5)取少量產物于試管中,加入少量蒸餾水,試管底部有沉淀生成,可聞到刺激性氨味(把濕潤的紅色石蕊試紙放在管口,試紙變藍),證明產物中含有氮化鎂;棄去上層清液,加入鹽酸,若觀察到有氣泡產生,則證明產物中含有未反應的鎂
【解析】(1)因為裝置比較復雜,所以在檢查裝置氣密性的時候要采取加熱法,即微熱b,這時G中有氣泡冒出,停止加熱冷卻后,G中插在溶液里的玻璃管形成一段水柱,則氣密性良好;(2)根據反應物(NaNO2和(NH4)2SO4)和生成物(N2)。可知該反應為歸中反應,所以化學方程式為2NaNO2+(NH4)2SO4 2N2↑+Na2SO4+4H2O;(3)從A中出來的氣體中可能含有O2,對后面的實驗會帶來干擾,所以在和Mg反應之前必須除去,而飽和的硫酸亞鐵溶液中含有(Fe2+),能除去O2;生成物Mg3N2極易和水發生反應,所以在制取反應前必須干燥(即濃硫酸的作用);(5)根據Mg3N2和H2O反應的方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,可知檢驗方法為取少量產物于試管中,加入少量蒸餾水,試管底部有沉淀生成,可聞到刺激性氨味(把濕潤的紅色石蕊試紙放在管口,試紙變藍),證明產物中含有氮化鎂;棄去上層清液,加入鹽酸,若觀察到有氣泡產生,則證明產物中含有未反應的鎂。
2N2↑+Na2SO4+4H2O;(3)從A中出來的氣體中可能含有O2,對后面的實驗會帶來干擾,所以在和Mg反應之前必須除去,而飽和的硫酸亞鐵溶液中含有(Fe2+),能除去O2;生成物Mg3N2極易和水發生反應,所以在制取反應前必須干燥(即濃硫酸的作用);(5)根據Mg3N2和H2O反應的方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,可知檢驗方法為取少量產物于試管中,加入少量蒸餾水,試管底部有沉淀生成,可聞到刺激性氨味(把濕潤的紅色石蕊試紙放在管口,試紙變藍),證明產物中含有氮化鎂;棄去上層清液,加入鹽酸,若觀察到有氣泡產生,則證明產物中含有未反應的鎂。


科目:高中化學 來源:2013-2014學年高考化學二輪復習四川配套訓練 第6講反應速率和化學平衡練習卷(解析版) 題型:選擇題
在一密閉容器中,由CO2和H2合成甲醇,在其他條件不變的情況下,探討溫度對反應的影響,實驗結果如下圖所示(注:T1,T2均大于300 ℃),下列說法正確的是( )。

A.溫度為T1時,從反應開始到平衡,生成甲醇的平均速率為v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
B.該反應在T1時的平衡常數比T2時的小
C.該反應為吸熱反應
D.處于A點的反應體系從T1變到T2,達到平衡時 增大
增大
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習四川配套訓練 第2講化學常用計量練習卷(解析版) 題型:填空題
某同學購買了一瓶××牌“84消毒液”,查閱相關資料和消毒液包裝說明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀釋100倍(體積比)后使用。
請根據以上信息和相關知識回答下列問題:
(1)該“84消毒液”的物質的量濃度為________ mol·L-1。
(2)該同學取100 mL該“84消毒液”稀釋后用于消毒,稀釋后的溶液中
c(Na+)=________ mol·L-1(假設稀釋后溶液密度為1.0 g·cm-3)。
(3)某實驗需用480 mL含25%NaClO的消毒液。該同學參閱該“84消毒液”的配方,欲用NaClO固體配制該消毒液。
①下列說法正確的是________。

A.如上圖所示的儀器中,有四種是不需要的,還需一種玻璃儀器
B.容量瓶用蒸餾水洗凈后,應烘干才能用于溶液配制
C.利用購買的商品NaClO來配制可能導致結果偏低
D.需要稱量的NaClO固體質量為143 g
②在配制過程中,下列操作可能使配制的溶液的濃度偏大的是________。
A.燒杯中溶液轉移到容量瓶中時,未洗滌燒杯
B.定容時,俯視刻度線
C.定容時,仰視刻度線
D.移液時,有少量液體濺出
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習四川配套訓練 第1講物質組成性質分類練習卷(解析版) 題型:選擇題
下列有關物質分類一定正確的是( )。
①強電解質:氯化氫、氫氧化鋇、摩爾鹽 ②弱電解質:草酸、純堿、醋酸銨 ③非電解質:液氨、二氧化硫、苯 ④同系物:CH2O2、C2H4O2、C3H6O2
A.①②③ B.①③ C.①④ D.②③
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習四川配套訓練 第13講實驗方案的設計練習卷(解析版) 題型:填空題
TiO2既是制備其他含鈦化合物的原料,又是一種性能優異的白色顏料。
(1)實驗室利用反應TiO2(s)+CCl4(g)  TiCl4(g)+CO2(g),在無水無氧條件下制備TiCl4,實驗裝置示意圖如下:
TiCl4(g)+CO2(g),在無水無氧條件下制備TiCl4,實驗裝置示意圖如下:

有關物質性質如下表:
物質 | 熔點/℃ | 沸點/℃ | 其他 |
CCl4 | -23 | 76 | 與TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮濕空氣產生白霧 |
儀器A的名稱是________。裝置E中的試劑是________。反應開始前依次進行如下操作:組裝儀器、________、加裝藥品、通N2一段時間后點燃酒精燈。反應結束后的操作包括:①停止通N2 ②熄滅酒精燈 ③冷卻至室溫。正確的順序為________(填序號)。欲分離D中的液態混合物,所采用操作的名稱是________。
(2)工業上由鈦鐵礦(FeTiO3)(含Fe2O3、SiO2等雜質)制備TiO2的有關反應包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
簡要工藝流程如下:

①試劑A為________。鈦液Ⅰ需冷卻至70 ℃左右,若溫度過高會導致產品TiO2產率降低,原因是__________________________________________
②取少量酸洗后的H2TiO3,加入鹽酸并振蕩,滴加KSCN溶液后無明顯現象,再加H2O2后出現微紅色,說明H2TiO3中存在的雜質離子是________。這種H2TiO3即使用水充分洗滌,煅燒后獲得的TiO2也會發黃,發黃的雜質是____________________(填化學式)。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習四川配套訓練 第12講化學實驗基礎練習卷(解析版) 題型:選擇題
安全是順利進行實驗的保障,下列實驗處理或方法正確的是( )。
A.尾氣(主要含氯氣)用澄清石灰水吸收較好
B.把氫氣和氯氣混合光照制氯化氫
C.導管口點燃一氧化碳時也要驗純
D.重金屬鹽有毒,如果不慎食入氯化鋇,喝硫酸銅溶液即可
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習四川配套訓練 第11講有機化學基礎練習卷(解析版) 題型:填空題
某芳香烴A可以從煤干餾得到的煤焦油中分離出來,以A為原料可以合成聚鄰氨基苯甲酸、扁桃酸等物質,其合成流程如下。

已知:
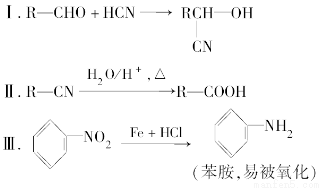
請回答下列問題:
(1)C的分子式為________。
(2)下列對相關反應類型的判斷合理的是________(填序號)。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
Ⅰ | 加成 | 水解 | 還原 | 取代 | 還原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 還原 | 加成 | 氧化 | 還原 | 縮聚 |
Ⅲ | 取代 | 水解 | 氧化 | 加成 | 氧化 | 還原 | 縮聚 |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 還原 | 氧化 | 加聚 |
(3)寫出反應③的化學方程式:_____________________________________。
(4)扁桃酸有多種同分異構體,其中既能與氯化鐵溶液發生顯色反應,又能與碳酸氫鈉溶液反應產生氣泡的同分異構體有________種,寫出其中一種的結構簡式:________。
(5)以芳香烴A為主要原料,還可以通過下列合成路線合成阿司匹林和冬青油:

①冬青油的結構簡式為__________________________________________。
②寫出反應Ⅴ的化學方程式:_______________________________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題9常見金屬元素及其重要化合物練習卷(解析版) 題型:填空題
下列轉化關系中,X、Y是生活中用途廣泛的兩種金屬單質,A、B是氧化物,A呈紅棕色,C、D、E是中學常見的三種化合物。分析轉化關系回答問題:

(1)請寫出反應①的化學方程式_____________________________________。
(2)檢驗D溶液中Y離子的方法是__________________________________。
(3)若試劑a是NaOH溶液,寫出單質X與NaOH溶液反應的離子方程式______________________________。
(4)若試劑b是H2SO4,工業上用E、H2SO4和NaNO2為原料制取高效凈水劑Y(OH)SO4,已知還原產物為NO,則該反應的化學方程式是________________________________________。
(5)工業上電解熔融的B制取X時,若陽極產生的氣體在標準狀況下的體積為33.6 m3,則陰極產物的質量為________kg。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題6化學反應速率和化學平衡練習卷(解析版) 題型:選擇題
一定條件下,在密閉容器中,能表示反應X(g)+2Y(g) 2Z(g)一定達到化學平衡狀態的是 ( )。
2Z(g)一定達到化學平衡狀態的是 ( )。
①X、Y、Z的物質的量之比為1∶2∶2 ②X、Y、Z的濃度不再發生變化
③容器中的壓強不再發生變化 ④單位時間內生成n mol Z,同時生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com