
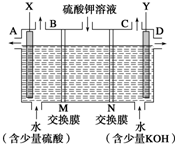
 某小組同學設想用如圖裝置電解硫酸鉀溶液來制取氧氣、氫氣、硫酸和氫氧化鉀.
某小組同學設想用如圖裝置電解硫酸鉀溶液來制取氧氣、氫氣、硫酸和氫氧化鉀.分析 (1)(2)目的是用如圖裝置電解硫酸鉀溶液來制取氧氣、氫氣、硫酸和氫氧化鉀,由裝置圖可知,硫酸應在左室得到,KOH在右室得到,左室為陽極室,氫氧根離子放電生成氧氣,M為陰離子交換膜,硫酸根離子通過陰離子交換膜進入左室,右室為陰極室,氫離子放電生成氫氣,N為陽離子交換膜,鉀離子通過陽離子交換膜進入右室;
(3)將制得的氫氣、氧氣和氫氧化鉀溶液組合為氫氧燃料電池(石墨為電極),負極發生氧化反應,氫氣再負極失去電子,堿性條件下生成水;
(4)計算氫氣物質的量,根據H元素化合價變化計算轉移電子,由電子轉移守恒可知,左室發生反應:2H2O-4e-=O2↑+4H+,根據電子轉移守恒計算H+的物質的量,進而計算算硫酸質量.
解答 解:目的是用如圖裝置電解硫酸鉀溶液來制取氧氣、氫氣、硫酸和氫氧化鉀,由裝置圖可知,硫酸應在左室得到,KOH在右室得到,左室為陽極室,氫氧根離子放電生成氧氣,M為陰離子交換膜,硫酸根離子通過陰離子交換膜進入左室,右室為陰極室,氫離子放電生成氫氣,N為陽離子交換膜,鉀離子通過陽離子交換膜進入右室.
(1)X為陽極,連接電源的正極,右室生成氫氣,從C口導出,
故答案為:正;C;
(2)由上述分析可知,M為陰離子交換膜,
故答案為:陰離子;
(3)將制得的氫氣、氧氣和氫氧化鉀溶液組合為氫氧燃料電池(石墨為電極),負極發生氧化反應,氫氣再負極失去電子,堿性條件下生成水,負極電極反應式為:H2-2e-+2OH-═2H2O,
故答案為:H2-2e-+2OH-═2H2O;
(4)生成氫氣物質的量為$\frac{11.2L}{22.4L/mol}$=0.5mol,轉移電子為0.5mol×2=1mol,轉移電子數目為6.02×1023,左室發生反應:2H2O-4e-=O2↑+4H+,生成氫離子為1mol,則得到硫酸為$\frac{1mol}{2}$=0.5mol,故得到硫酸質量為0.5mol×98g/mol=49g,
故答案為:49;6.02×1023.
點評 本題考查電解原理應用及有關計算,關鍵是根據裝置圖與電解原理判斷陽極與陰極,理解掌握離子放電順序,掌握電化學計算中電子轉移守恒應用.


 能考試期末沖刺卷系列答案
能考試期末沖刺卷系列答案科目:高中化學 來源:2016-2017學年江西省高二上第一次月考化學卷(解析版) 題型:填空題
在一個容積固定的反應器中,有一可左右滑動的密封隔板,左、右兩側分別進行如下可逆反應:2SO2(g)+O2(g) 2SO3(g);3Fe
2SO3(g);3Fe (s)+4H2O(g)
(s)+4H2O(g) Fe3O
Fe3O 4(g)+4H2(
4(g)+4H2( g)。左側中加入SO2、O2、SO3的物質的量分別為x mol、3.25mol、1mol;右側中加入9 mol的水蒸氣和適量的鐵粉(忽略鐵粉對容器體積的影響)。當x在一定范圍內變化時,均可以通過調節反應器的溫度,使兩側反應都達到平衡,并且隔板恰好處于反應器位置2處。請填寫以下空白:
g)。左側中加入SO2、O2、SO3的物質的量分別為x mol、3.25mol、1mol;右側中加入9 mol的水蒸氣和適量的鐵粉(忽略鐵粉對容器體積的影響)。當x在一定范圍內變化時,均可以通過調節反應器的溫度,使兩側反應都達到平衡,并且隔板恰好處于反應器位置2處。請填寫以下空白:
(1)若x=1.5,則左側反應在起始時向__________(填“正”或“逆”)反應方向進行。欲使反應維持向該方向進行,則x的取值范圍是______________。
(2)若x=2,平衡時混合氣中SO2所占的體積分 數為______________。欲使起始反應維持向該方向進行,則x的最大值應小于____________。
數為______________。欲使起始反應維持向該方向進行,則x的最大值應小于____________。
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
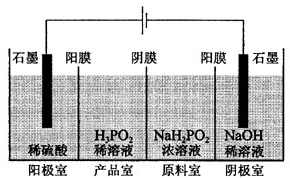 次磷酸(H3PO2)是一種精細磷化工產品,具有較強還原性.回答下列問題:
次磷酸(H3PO2)是一種精細磷化工產品,具有較強還原性.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定條件下,5.2g乙炔和苯的混合氣體中含有的碳原子數為0.4NA | |
| B. | 標準狀況下,2.24L氖氣所含原子數為0.2NA | |
| C. | 1mol硫酸氫鈉固體中含陽離子總數2 NA | |
| D. | 5.6g Fe與足量的水蒸氣完全反應,轉移電子的數目為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用合適的催化劑可大大提高生產效率 | |
| B. | 由反應需在300℃進行,可知該反應是吸熱反應 | |
| C. | 增大原料氣中CO2的百分含量,可以提高H2的轉化率 | |
| D. | 70MPa的壓力,不僅可以增加單位時間內的產出,還可以提高CO2和H2的利用率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
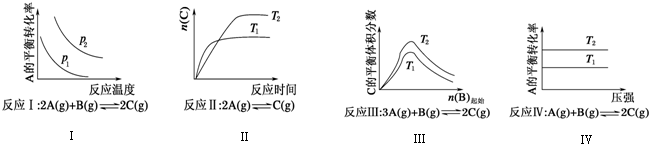
| A. | 反應Ⅰ:△H>0,p2>p1 | B. | 反應Ⅲ:△H>0,T2>T1或△H<0,T2<T1 | ||
| C. | 反應Ⅱ:△H>0,T1>T2 | D. | 反應Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上第一次月考化學卷(解析版) 題型:填空題
如圖所示,當關閉K時,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始時體積V(A)=V(B)=a L,在相同溫度和有催化劑存在的條件下,兩容器各自發生下列反應:2X(g)+2Y(g)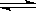 Z(g)+2W(g)△H<0達到平衡(Ⅰ)時V(B)=0.9a L,試回答:
Z(g)+2W(g)△H<0達到平衡(Ⅰ)時V(B)=0.9a L,試回答:
(1)B中X的轉化率α(X)B為_________。
(2)A中W和B中Z的物質的量的比較:n(W)A __________________ n(Z)B(填<、>、或=)
(3)打開K,過一段時間重新達平衡(Ⅱ)時,B的體積為_________升(用含a的代數式表示,連通管中氣體體積不計)
(4)要使B容 器恢復原來反應前的體積,可采取的措施是____________________。
器恢復原來反應前的體積,可采取的措施是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A | |||||||
| B | C | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
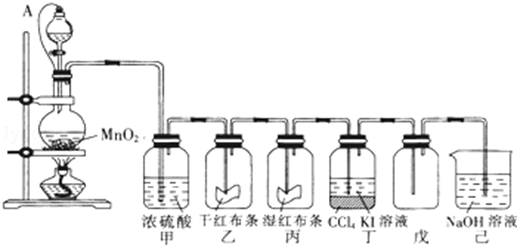
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com