
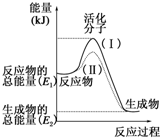
 請認真觀察如圖,然后回答問題.
請認真觀察如圖,然后回答問題.分析 (1)依據圖象分析反應物的能量大于生成物的能量,反應放熱;反應的焓變=生成物的能量-反應物的能量;
(2)化學反應中,化學鍵斷裂吸收能量,形成新化學鍵放出能量,根據方程式計算分別吸收和放出的能量,以此計算反應熱并判斷吸熱還是放熱;
(3)根據常見的放熱反應有:所有的物質燃燒、所有金屬與酸反應、金屬與水反應,所有中和反應;絕大多數化合反應和鋁熱反應;
常見的吸熱反應有:絕大數分解反應,個別的化合反應(如C和CO2),少數分解置換以及某些復分解(如銨鹽和強堿).
解答 解:(1)依據圖象分析反應物的能量大于生成物的能量,反應放熱,故答案為:放熱;
(2)在反應H2+I2?2HI中,斷裂1molH-H鍵,1molI-I鍵共吸收的能量為:1×436kJ+151kJ=587kJ,生成2molHI,共形成2molH-I鍵,放出的能量為:2×299kJ=598kJ,吸收的能量少,放出的能量多,所以該反應為放熱反應,放出的熱量為:598kJ-587kJ=11kJ,故答案為:放出;11;
(3)①物質燃燒屬于放熱反應; ②炸藥爆炸屬于放熱反應; ③酸堿中和反應屬于放熱反應; ④二氧化碳通過熾熱的碳雖然屬于化合反應,但為吸熱反應;
⑤食物因氧化而腐敗屬于放熱反應; ⑥Ba(OH)2•8H2O與NH4Cl反應為吸熱反應 ⑦鐵粉與稀鹽酸反應屬于放熱反應;
所以放熱反應有:①②③⑤⑦;吸熱反應有:④⑥,
故答案為:①②③⑤⑦;④⑥.
點評 本題考查焓變的求算,△H=生成物能量-反應物能量=反應物鍵能和-生成物鍵能和,以及化學反應的熱量變化,學生應注重歸納中學化學中常見的吸熱或放熱的反應,對于特殊過程中的熱量變化的要熟練記憶來解答此類習題.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | X可能是第二周期非金屬元素 | B. | Y可能與X同主族 | ||
| C. | X可能是第三周期金屬元素 | D. | Y一定是金屬元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
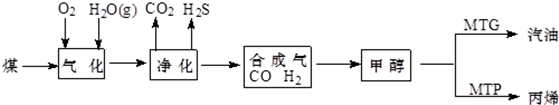
 .
.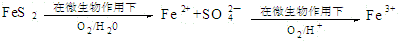
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | Na2S04溶液 | AgN03溶液 | 現象 | ||
| 體積/mL | 濃度/(mol•L-1) | 體積/滴 | 濃度/(mol•L-1) | ||
| ① | 1 | l | 3 | 2 | 出現大量白色沉淀 |
| ② | 1 | 1 | 3 | 0.5 | 出現少量白色沉淀 |
| ③ | 1 | 1 | 3 | 0.1 | 有些許渾濁 |
| ④ | 1 | 1 | 3 | 0.0l | 無明顯變化 |
| 編號 | AgNO3濃度/(mol•L-1) | 稀釋后Ag+濃度/(mol•L-1) | 混合液中SO42-的最小理論檢出濃度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.0l | 0.12 |
| ④ | 0.001 |
| 編號 | AgNO3溶液 濃度/(mol•L-1) | 現象 | 向沉淀中滴加硝酸后的現象 |
| ① | 2 | 出現大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加濃硝酸,沉淀較快消失 |
| ② | 0.5 | 出現少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
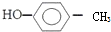
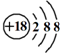
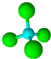
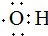
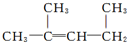 的名稱:1,3-二甲基-2丁烯( )
的名稱:1,3-二甲基-2丁烯( )| A. | ⑤ | B. | ④⑤ | C. | ③⑦ | D. | ②⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈹(Be)的氧化物的水化物可能具有兩性 | |
| B. | 砹(At)為有色固體,HAt不穩定,AgAt感光性很強,但不溶于水也不溶于酸 | |
| C. | 硫酸鍶(SrSO4)是難溶于水的白色固體 | |
| D. | 硒化氫(H2Se)是有色、有毒的氣體,比H2S穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 50mL | B. | 72mL | C. | 78mL | D. | 100mL |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com