
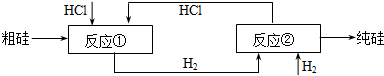
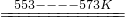 SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)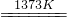 Si(純)+3HCl
Si(純)+3HCl
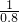 =1.25體積,所以要補充0.25體積的H2,生成了3體積的HCl,為了保證有4體積的HCl,就要補充1體積的HCl,所以結果是V( HCl):V(H2)=(4-3):(1.25-1)=4:1,故案為:4:1;
=1.25體積,所以要補充0.25體積的H2,生成了3體積的HCl,為了保證有4體積的HCl,就要補充1體積的HCl,所以結果是V( HCl):V(H2)=(4-3):(1.25-1)=4:1,故案為:4:1; 

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
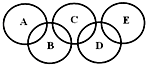 如圖所示的五元環代表A、B、C、D、E五種化合物,圓圈交叉部分指兩種化合物含有一種相同元素,五種化合物由五種短周期元素形成,每種化合物僅含兩種元素,A是沼氣的主要成分,B、E分子中所含電子數均為18,B不穩定,具有較強的氧化性,其稀溶液是醫療上廣泛使用的消毒劑,E的分子結構模型為
如圖所示的五元環代表A、B、C、D、E五種化合物,圓圈交叉部分指兩種化合物含有一種相同元素,五種化合物由五種短周期元素形成,每種化合物僅含兩種元素,A是沼氣的主要成分,B、E分子中所含電子數均為18,B不穩定,具有較強的氧化性,其稀溶液是醫療上廣泛使用的消毒劑,E的分子結構模型為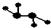 ,C、D均為原子晶體,C可作為光導纖維的主要材料,D中所含兩種元素的原子個數比為3:4,電子總數之比為3:2.根據以上信息回答下列問題:
,C、D均為原子晶體,C可作為光導纖維的主要材料,D中所含兩種元素的原子個數比為3:4,電子總數之比為3:2.根據以上信息回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:單選題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
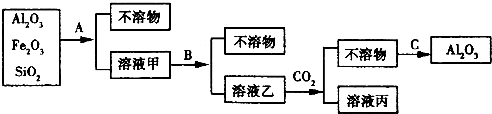
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度(℃) | 60 | 240 | 930 | 1000 |
| 殘留固體質量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com