
| A. | NaHSO3溶液中存在:c(Na+)>c(HSO3-)>c(OH-)>c(H+)>c(SO32-) | |
| B. | 當吸收液呈中性時:c(Na+)=2c(SO32-)+c(HSO3-) | |
| C. | 含等物質的量的Na2SO3和NaHSO3的溶液中,陰離子數目相等 | |
| D. | Na2SO3和NaHSO3都能抑制水的電離 |
分析 A.NaHSO3溶液pH<7,該溶液中亞硫酸根離子電離大于水解;
B.當吸收液呈中性時,c(H+)=c(OH-),依據溶液中電荷守恒分析;
C.含等物質的量的Na2SO3和NaHSO3的溶液中,亞硫酸根離子水解程度大于亞硫酸氫根離子,亞硫酸鈉溶液顯堿性,亞硫酸氫鈉溶液顯酸性;
D.Na2SO3和溶液顯堿性是亞硫酸根離子水解促進水的電離,NaHSO3都溶液顯酸性,亞硫酸氫根離子電離大于水解,能抑制水的電離;
解答 解:A.NaHSO3溶液pH<7,該溶液中亞硫酸根離子電離大于水解,溶液中離子濃度大小c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)>c(H2SO3),故A錯誤;
B.當吸收液呈中性時,c(H+)=c(OH-),溶液中存在的電荷守恒為c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-)得到c(Na+)=2c(SO32-)+c(HSO3-),故B正確;
C.含等物質的量的Na2SO3和NaHSO3的溶液中,亞硫酸根離子水解程度大于亞硫酸氫根離子,亞硫酸鈉溶液顯堿性,亞硫酸氫鈉溶液顯酸性,溶液中氫氧根離子數目不同,溶液中陰離子數目不相等,故C錯誤;
D.Na2SO3和溶液顯堿性是亞硫酸根離子水解促進水的電離,NaHSO3都溶液顯酸性,亞硫酸氫根離子電離大于水解,電離出的氫離子能抑制水的電離,故D錯誤;
故選B.
點評 本題考查了電解質溶液中離子濃度大小比較,電荷守恒和物料守恒的計算應用,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 決定化學反應速率的主要因素是參加反應的物質的性質 | |
| B. | 升高溫度可使吸熱反應的反應速率增大.使放熱反應的反應速率減小 | |
| C. | 等量的甲烷在純氧氣中燃燒的火焰的溫度比在空氣中燃燒時高 | |
| D. | 用物質的量濃度相同的鹽酸分別與相同質量的石灰石塊和石灰石粉末反應,石灰石快反應速率慢 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 )是一種可降解的聚酯類高分子材料,在材料的生物相容性方面有很好的應用前景.PPG的一種合成路線如下:
)是一種可降解的聚酯類高分子材料,在材料的生物相容性方面有很好的應用前景.PPG的一種合成路線如下:


 .
. .
. .
. .
. 的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下:CH3CH2Br$→_{加熱}^{NaOH/醇}$CH2=CH2$→_{催化劑}^{H_{2}O}$CH3CH2OH.
的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下:CH3CH2Br$→_{加熱}^{NaOH/醇}$CH2=CH2$→_{催化劑}^{H_{2}O}$CH3CH2OH.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 立即撤離火災現場并撥打119報警 | |
| B. | 若逃生通道被堵,應迅速轉移到窗口邊或陽臺上等待救援 | |
| C. | 若被困在室內,應立即封堵火、煙的進口,并站在室內最高處等待救援 | |
| D. | 若被困在火災現場,應盡可能貼近地面向火勢小、煙霧少的方向撤離 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SiO2 是酸性氧化物,能與NaOH溶液反應 | |
| B. | Na2O、Na2O2組成元素相同,與 CO2反應產物也相同 | |
| C. | CO、NO、NO2都是大氣污染氣體,在空氣中都能穩定存在 | |
| D. | 通過化學變化可以實現16O與18O間的相互轉化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強電解質一定是離子化合物,弱電解質一定是共價化合物 | |
| B. | 強電解質一定是易溶化合物,弱電解質一定是難溶化合物 | |
| C. | SO3溶于水后水溶液導電性很強,所以SO3是強電解質 | |
| D. | 強電解質與弱電解質的本質區別是在水溶液中能否完全電離 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
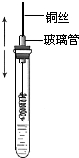 某同學在學習乙醇的知識后,設計了如下的實驗. 操作步驟為:
某同學在學習乙醇的知識后,設計了如下的實驗. 操作步驟為:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)某有機物含碳85.7%、氫14.3%,向80g含溴5%的溴水中通入該有機物,溴水恰好完全褪色,此時液體總重81.4g.
(1)某有機物含碳85.7%、氫14.3%,向80g含溴5%的溴水中通入該有機物,溴水恰好完全褪色,此時液體總重81.4g. .任選其中一種寫出其生成高聚物的化學方程式
.任選其中一種寫出其生成高聚物的化學方程式 (或
(或
 +3HNO3
+3HNO3
 +3H2O.
+3H2O.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com