
| A. | 40.5% | B. | 60.6% | C. | 81.0% | D. | 100% |
科目:高中化學 來源: 題型:選擇題
| A. | 鈉和氫氣分別在氯氣中燃燒,都產生白色煙霧 | |
| B. | 銅絲在氯氣中燃燒,生成藍色的氯化銅 | |
| C. | 液氯和氯水中滴入硝酸銀溶液均會產生白色沉淀 | |
| D. | 新制氯水顯酸性,向其中滴加少量紫色石蕊試液后溶液呈紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
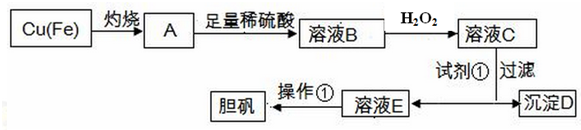
| 物質 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 開始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
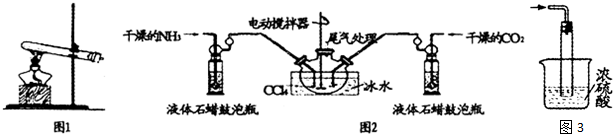
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
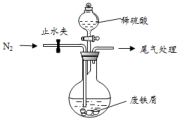 醫療上綠礬(FeSO4•7H2O)是治療缺鐵性貧血的特效藥.某化學興趣小組對綠礬進行了如下的探究:
醫療上綠礬(FeSO4•7H2O)是治療缺鐵性貧血的特效藥.某化學興趣小組對綠礬進行了如下的探究:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
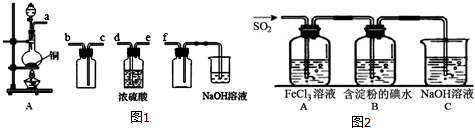
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
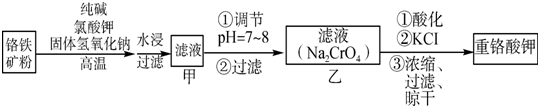
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的體積(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
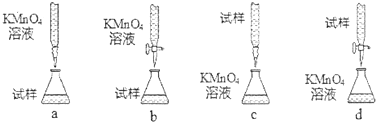
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com