
分析 (1)計算1mol二氧化碳和氫氣化合生成甲醇和水放熱,結合熱化學方程式書寫方法標注物質聚集狀態(tài)和反應焓變寫出;
(2)依據碳元素守恒計算合成甲醇物質的量,根據熱化學方程式計算放出的熱量;
(3)依據合成甲醇的熱化學方程式和H2O(g)═H2O(l)△H=-44kJ/mol,利用蓋斯定律計算得到1mol二氧化碳反應放出熱量,得到22g二氧化碳即0.5mol二氧化碳反應放出的熱量.
解答 解:(1)已知4.4g CO2氣體與H2經催化加氫生成CH3OH氣體和水蒸氣時放出4.95kJ的能量,則1mol二氧化碳全部反應放熱49.5KJ;結合熱化學方程式書寫方法寫出熱化學方程式為:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;
故答案為:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.5 kJ/mol;
(2)n(CH3OH)=n(CO2)=$\frac{4.48×103L}{22.4L/mol}$×22%=44mol,每生成1mol CH3OH(g)放熱49.5kJ,則此過程中放出熱量為:(44×49.5)kJ=2178kJ;
故答案為:44mol;2178;
(3)由H2O(g)═H2O(l)△H=-44kJ/mol以及(1)中的熱化學方程式可知,4.48m3(已折合為標準狀況)的CO2物質的量為1mol,1mol CO2完全合成CH3OH并生成液態(tài)水時放出熱量為44kJ+49.5kJ=93.5kJ.則22g CO2即0.5mol CO2與H2反應時,放出熱量為93.5kJ÷2=46.75kJ,
故答案為:46.75kJ.
點評 本題考查了熱化學方程式書寫和計算應用,掌握蓋斯定律計算是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 40.5% | B. | 60.6% | C. | 81.0% | D. | 100% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
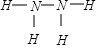 ,已知液態(tài)肼的標準燃燒熱為-622kJ/mol,寫出發(fā)生燃燒發(fā)生的熱化學方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.
,已知液態(tài)肼的標準燃燒熱為-622kJ/mol,寫出發(fā)生燃燒發(fā)生的熱化學方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5min內用O2表示的反應速率為0.12mol/(L•min) | |
| B. | 加入催化劑,可使該反應的化學反應速率加快,△H變小 | |
| C. | SO2的平衡濃度為0.12mol/L | |
| D. | 達到平衡時,若增大容器的體積,則該反應的化學反應速率減慢 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
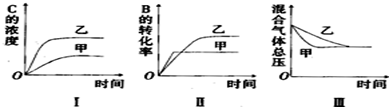
| A. | 圖I研究的可能是不同催化劑對反應的影響,且乙使用的催化劑效率較高 | |
| B. | 圖Ⅱ研究的可能是壓強對反應的影響,且甲的壓強較高 | |
| C. | 圖Ⅱ研究的可能是溫度對反應的影響,且甲的溫度較高 | |
| D. | 圖Ⅲ研究的可能是不同催化劑對反應的影響,且乙使用的催化劑效率較高 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com