
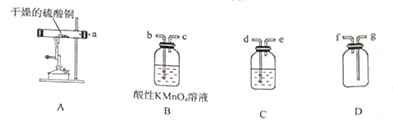
 CuSO4•5H2O是銅的重要化合物,有著廣泛的應用.硫酸銅在高溫下分解可得到SO2、SO3、O2和Cu2O.
CuSO4•5H2O是銅的重要化合物,有著廣泛的應用.硫酸銅在高溫下分解可得到SO2、SO3、O2和Cu2O.分析 I.(1)銅與濃硝酸反應生成二氧化氮和硝酸銅;
(2)根據反應物判斷可能存在的雜質,溶解度不同的可溶性鹽可用重結晶法分離;
II.(1)硫酸銅分解生成CuO、二氧化硫、三氧化硫和氧氣,檢驗三氧化硫用BaCl2溶液,檢驗二氧化硫用酸性高錳酸鉀溶液,并且用高錳酸鉀溶液吸收二氧化硫;
(2)B裝置中的溶液檢驗并吸收二氧化硫,品紅溶液的濃度較小,不能完全吸收二氧化硫;
(3)三氧化硫與BaCl2反應生成白色沉淀,二氧化硫與BaCl2不反應;用帶火星的木條檢驗氧氣;Cu2O固體溶于鹽酸會形成藍色溶液,同時有固體剩余.
解答 解:I.(1)銅與濃硝酸反應為:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,生成硫酸銅和二氧化氮氣體,所以反應現象為:溶液呈藍色,有紅棕色氣體生成;
故答案為:溶液呈藍色,有紅棕色氣體生成;
(2)混有硝酸銅雜質,需利用溶解度的不同,用重結晶的方法進行分離,
故答案為:Cu(NO3)2、重結晶;
II.(1)硫酸銅分解生成CuO、二氧化硫、三氧化硫和氧氣,檢驗三氧化硫用BaCl2溶液,所以C試劑瓶中盛放的溶液為BaCl2溶液;檢驗二氧化硫用酸性高錳酸鉀溶液,并且用高錳酸鉀溶液吸收二氧化硫;用D裝置收集氧氣,所以儀器的導管連接順序為adebcgf;
故答案為:BaCl2溶液;adebcgf;
(2)B裝置中的溶液檢驗并吸收二氧化硫,品紅溶液的濃度較小,用品紅溶液檢驗二氧化硫,但不能完全吸收二氧化硫,會用二氧化硫剩余,二氧化氯與氧氣一起進入D中,會干擾氧氣的檢驗;
故答案為:因為SO2不能全部被品紅溶液吸收,影響氧氣的檢驗;
(3)三氧化硫與BaCl2反應生成白色沉淀,二氧化硫與BaCl2不反應,SO3與BaCl2溶液反應生成BaSO4沉淀,其反應的離子方程式為:SO3+H2O+Ba2+=BaSO4↓+2H+;
D裝置收集的氣體為氧氣,將帶火星的木條伸入D中,若木條復燃,說明D中氣體是氧氣;Cu2O鹽酸反應生成氯化銅和Cu,會形成藍色溶液,同時有固體剩余,則檢驗方法為:取少量固體產物于試管中,加入足量的稀鹽酸,若得到藍色溶液與紅色固體,則固體產物中含有Cu2O.
故答案為:SO3+H2O+Ba2+=BaSO4↓+2H+;將帶火星的木條伸入D中;取少量固體產物于試管中,加入足量的稀鹽酸,若得到藍色溶液與紅色固體,則固體產物中含有Cu2O.
點評 本題考查了銅及其化合物的性質、實驗探究方案設計、物質的檢驗等,題目難度中等,側重于考查學生的實驗探究能力和對基礎知識的綜合應用能力,注意把握常見物質的檢驗方法.


 課課優能力培優100分系列答案
課課優能力培優100分系列答案 優百分課時互動系列答案
優百分課時互動系列答案科目:高中化學 來源: 題型:選擇題
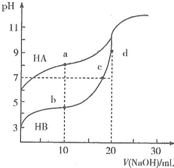 常溫下,用0.10mol•L-1NaOH溶液分別滴定20.00mL濃度均為0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲線如圖所示.下列說法正確的是( )
常溫下,用0.10mol•L-1NaOH溶液分別滴定20.00mL濃度均為0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲線如圖所示.下列說法正確的是( )| A. | HA的酸性強于HB | B. | d點溶液中:c(Na+)>c(OH-)>c(B-)>c(H+) | ||
| C. | a和b點溶液中:c(B-)<c(A-) | D. | b點溶液中:c(B-)+2c(OH)-=c(HB)+2c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | X | Y | Z |
| A | Al | NaOH(aq) | CuO(s) |
| B | Fe3O4 | HNO3(aq) | HI(aq) |
| C | Mg | NaOH(aq) | HCl(aq) |
| D | NaOH(aq) | AlCl3(aq) | HNO3(aq) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 電導率可用于衡量電解質溶液導電能力大小.室溫下,用0.100mol•L-lNH3•H2O滴定 10.00mL濃度均為 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲線如圖所示.下列說法正確的是( )
電導率可用于衡量電解質溶液導電能力大小.室溫下,用0.100mol•L-lNH3•H2O滴定 10.00mL濃度均為 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲線如圖所示.下列說法正確的是( )| A. | ①點溶液中c (H+)為0.200 mol•L-l | |
| B. | 若反應容器與外界沒有熱交換,反應后溶液溫度高低為①>③>② | |
| C. | pH的大小為:③>②>①,且③點溶液中有c(Cl-)>c(CH3COO-) | |
| D. | ③點后因離子數目減少使溶液電導率略降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 在2L的密閉容器中,高溫下發生下列反應:
在2L的密閉容器中,高溫下發生下列反應:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com