
分析 (1)鹵水中含有Mg2+,加入Ca(OH)2提供OH-,Mg2+與OH-反應生成Mg(OH)2,
(2)①灼燒Mg(OH)2 得到MgO與水;
②由題目信息可知,Si與MgO反應生成Mg(蒸汽),同時生成二氧化硅;
(3)①從溶液得到晶體,需要經過加熱濃縮、冷卻結晶、過濾等操作;
②MgCl2•6H2O與SOCl2混合后加熱,可獲得無水MgCl2與SO2,由元素守恒與白霧現象可知生成HCl;
(4)①三硅酸鎂可以看作MgO、SiO2的混合物,MgO與HCl反應生成氯化鎂與水,利用原子守恒配平;
②硫酸與氧化鎂、氫氧化鈉反應生成MgSO4、Na2SO4,根據硫酸根守恒n(H2SO4)=n(MgSO4)+n(Na2SO4),由鈉離子守恒2n(Na2SO4)=n(NaOH),聯立計算n(MgSO4),再根據Mg原子守恒計算x的值.
解答 解:(1)利鹵水中含有Mg2+,加入Ca(OH)2提供OH-,Mg2+與OH-反應生成Mg(OH)2,反應離子方程式為:Mg2++Ca(OH)2=Mg(OH)2+Ca2+,
故答案為:Mg2++Ca(OH)2=Mg(OH)2+Ca2+;
(2)①灼燒Mg(OH)2 得到MgO與水,化學方程式為:Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,
故答案為:Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;
②由題目信息可知,Si與MgO反應生成Mg(蒸汽),同時生成二氧化硅,反應方程式為:Si+2MgO$\frac{\underline{\;1200℃\;}}{\;}$2Mg↑+SiO2,
故答案為:Si+2MgO$\frac{\underline{\;1200℃\;}}{\;}$2Mg↑+SiO2;
(3)①從溶液得到晶體,需要經過加熱濃縮、冷卻結晶、過濾等操作,
故答案為:加熱濃縮、冷卻結晶;
②MgCl2•6H2O與SOCl2混合后加熱,可獲得無水MgCl2與SO2,由元素守恒與白霧現象可知生成HCl,反應方程式為:MgCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+6SO2↑+12HCl↑,
故答案為:MgCl2•6H2O+6SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+6SO2↑+12HCl↑;
(4)①三硅酸鎂可以看作MgO、SiO2的混合物,MgO與HCl反應生成氯化鎂與水,配平后離子方程式為:xMgO•3SiO2+2xH+=xMg2++3SiO2+xH2O,
故答案為:2x;x;3;xH2O;
②硫酸與氧化鎂、氫氧化鈉反應生成MgSO4、Na2SO4,根據硫酸根守恒n(H2SO4)=n(MgSO4)+n(Na2SO4)=0.5000mol/L×0.015L=0.0075mol,由鈉離子守恒2n(Na2SO4)=n(NaOH)=0.5000mol/L×0.014L=0.007mol,則n(Na2SO4)=0.0035mol,故n(MgSO4)=0.004mol,則$\frac{0.004}{x}$×[40x+3×(32+28)]=0.52,解得x=2,
故答案為:2.
點評 本題考查實驗制備原理、物質組成的測定、物質的分離提純、滴定原理應用等,側重對原理中化學方程式的考查,是對學生綜合能力的考查,難度中等.


 智趣寒假作業云南科技出版社系列答案
智趣寒假作業云南科技出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 元素W:位于元素周期表中的第三周期,ⅢA族 | |
| B. | 元素X:它的原子中M層比L層少2個電子 | |
| C. | 元素Y:它的焰色反應顏色呈黃色 | |
| D. | 元素Z:它的二價陽離子核外電子總數與氬原子相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 在侯氏制堿工業中,向飽和氯化鈉溶液中先通二氧化碳,后通氨氣 | |
| B. | 在硫酸工業、合成氨工業、硝酸工業中,皆采用循環操作提高原料利用率 | |
| C. | 在氯堿工業,電解槽一般用鐵網作電極 | |
| D. | 合成氨工業用天然氣造氣的方法中,與水蒸汽高溫反應優于熱分解法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
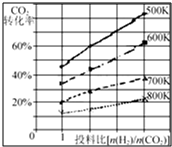 在一定條件下,將燃煤廢氣中的CO2轉化為二甲醚的反應為:
在一定條件下,將燃煤廢氣中的CO2轉化為二甲醚的反應為:| 時間(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 壓強比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
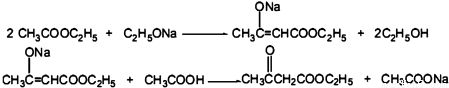

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由于K=c2(Z)/[c2(X)•c(Y)],隨著反應的進行,Z的濃度不斷增大,X,Y的濃度不斷減小,平衡常數不斷增大 | |
| B. | 當溫度不變時,增大反應物的濃度,使K變小;增大生成物的濃度,使K增大 | |
| C. | 可逆反應達到平衡時,逆反應便立即停止了 | |
| D. | 溫度發生變化,上述的K值也發生變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com