

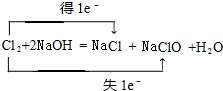 ;
;
分析 (1)(2)(3)向NaOH溶液中通入Cl2,發生的反應為Cl2+2NaOH=NaCl+NaClO+H2O,然后向溶液中加入Fe(NO3)3,發生的反應為3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,向溶液中加入HCl來調節溶液的pH,然后過濾得到NaCl,向濾液中加入飽和KOH,利用溶解度不同,發生反應:Na2FeO4+2KOH=K2FeO4+2NaOH,過濾得到粗的K2FeO4,通過提純得到純的K2FeO4.
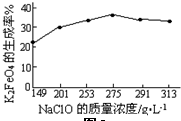
(4)由圖可知,NaClO在275g/L時,K2FeO4的生成率最高,進而計算其物質的量濃度;
(5)K2FeO4 在水溶液中易水解,應選擇非水溶液抑制K2FeO4水解,進行洗滌.
解答 解:向NaOH溶液中通入Cl2,發生的反應為Cl2+2NaOH=NaCl+NaClO+H2O,然后向溶液中加入Fe(NO3)3,發生的反應為3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,向溶液中加入HCl來調節溶液的pH,然后過濾得到NaCl,向濾液中加入飽和KOH,利用溶解度不同,發生反應:Na2FeO4+2KOH=K2FeO4+2NaOH,過濾得到粗的K2FeO4,通過提純得到純的K2FeO4,
(1)反應①的化學方程式為:Cl2+2NaOH=NaCl+NaClO+H2O,標出電子轉移數目與方向為: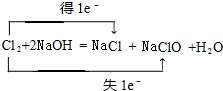 ,
,
故答案為: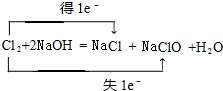 ;
;
(2)反應器中發生的反應為:3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,離子方程式為:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O
故答案為:2;3;10;2;3;5;H2O;
(3)轉化過程利用溶解度不同,由Na2FeO4轉化為K2FeO4,反應方程式為:Na2FeO4+2KOH=K2FeO4+2NaOH,
故答案為:Na2FeO4+2KOH=K2FeO4+2NaOH;
(4)由圖可知,NaClO在275g/L時,K2FeO4的生成率最高,NaClO的物質的量濃度為$\frac{\frac{275g}{74.5g/mol}}{1L}$=3.7mol/L,
故答案為:3.7mol/L,
(5)操作①是分離互不相溶的固體與液態,應采取過濾操作,K2FeO4 在水溶液中易水解,選擇異丙醇洗滌可以抑制K2FeO4水解,
故答案為:過濾;K2FeO4 在水溶液中易水解,選擇異丙醇洗滌可以抑制K2FeO4水解.
點評 本題考查學生對工藝流程的理解、對操作的評價分析、物質的分離提純、氧化還原反應等,需要學生具有扎實的基礎知識及靈活運用知識解決問題的能力,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 32gO2所含的氧原子數目為NA | |
| B. | 標準狀況下,22.4L水中所含的水分子數目為NA | |
| C. | 1mol•L-1Na2SO4溶液中含有的鈉離子數目為2NA | |
| D. | 1molMg變為Mg2+時失去電子的數目為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 某研究小組探究:
某研究小組探究:查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Na<Mg<Al | B. | 熱穩定性:HCl>HBr>HI | ||
| C. | 酸性強弱:H2SiO3<H2CO3<H2SO4 | D. | 熔點:SiO2>NaCl>CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
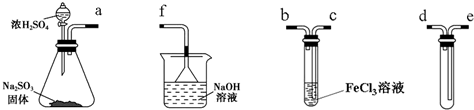
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
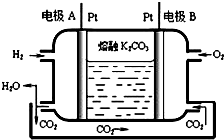 運用所學化學原理,解決下列問題:
運用所學化學原理,解決下列問題:| 溫度/ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
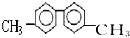
| A. | 該烴分子中最多有6個碳原子處于同一直線上 | |
| B. | 該烴分子中至少有10個碳原子處于同一平面上 | |
| C. | 該烴的一氯代物最多有四種 | |
| D. | 該烴是苯的同系物,能使酸性高錳酸鉀溶液褪色 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com