
【題目】高爐煉鐵中發生的基本反應之一如下:FeO(s)+CO(g) →Fe(s)+CO2(g)-Q,已知1100℃時,K=0.263
(1)寫出該反應的平衡常數表達式____。溫度升高,化學平衡移動后達到新的平衡,高爐中CO2和CO的體積比值___,平衡常數K值___(以上選填“增大”、“減小”或“不變”)。
(2)1100℃時測得高爐中c(CO2)=0025mol/L、c(CO)=0.1mol/L,在這種情況下,該反應是否處于化學平衡狀態___(選填“是”或“否”),此時,化學反應速率是v正___v逆(選填“大于”、“小于”或“等于”),其原因是_____。
【答案】K=![]() 增大 增大 否 大于 因溫度不變,K值不變,
增大 增大 否 大于 因溫度不變,K值不變,![]() <0.263,未達到平衡狀態,為增大
<0.263,未達到平衡狀態,為增大![]() 的值反應正向進行,故v正>v逆。
的值反應正向進行,故v正>v逆。
【解析】
(1)依據平衡常數的概念書寫;升高溫度平衡向吸熱方向移動,根據平衡移動的方向判斷平衡常數K值;
(2)依據濃度計算濃度商結合平衡常數進行比較判斷反應進行的方向.
(1)固體不在平衡表達式中出現,平衡常數表達式K=c(CO2)/c(CO);反應吸熱,升高溫度平衡向正反應方向移動,高爐中CO2和CO的體積比值增大,平衡常數K值增大;
(2)1100℃時測得高爐中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,濃度商Q=
0.025mol·L-1/0.1mol·L-1=0.25<K=0.26,說明平衡正向進行,反應未達到平衡,v正>v逆。原因:因溫度不變,K值不變,![]() <0.263,未達到平衡狀態,為增大
<0.263,未達到平衡狀態,為增大![]() 的值,反應正向進行,故v正>v逆。
的值,反應正向進行,故v正>v逆。


科目:高中化學 來源: 題型:
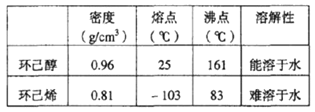
【題目】某化學小組采用類似制乙酸乙酯的裝置(如圖),以環己醇制備環己烯。
已知: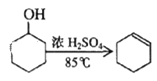 +H2O
+H2O
(1)制備粗品
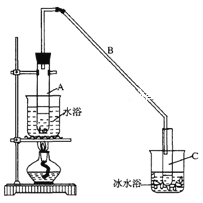
將12.5 mL環己醇加入試管A中,再加入l mL濃硫酸,搖勻后放入碎瓷片,緩慢加熱至
反應完全,在試管C內得到環己烯粗品。
①導管B除了導氣外還具有的作用是____________
② 試管C置于冰水浴中的目的是______________________________________________
(2)制備精品
① 環己烯粗品中含有環己醇和少量酸性雜質等。加入飽和食鹽水,振蕩、靜置、分層,環己烯在_____層(填:上、下),分液后用__________洗滌。
A KMnO4溶液 B 稀H2SO4 C Na2CO3溶液
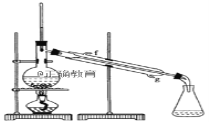
② 再將環己烯按如圖裝置蒸餾,冷卻水從_____口(填g或f)進入。
③ 收集產品時,控制的溫度應在_____左右,實驗制得的環己烯精品質量低于理論產量,可能的原因是___________
a 蒸餾時從70℃開始收集產品 b 環己醇實際用量多了 c 制備粗品時環己醇隨產品一起蒸出
(3)以下區分環己烯精品和粗品的方法,合理的是_____
A用酸性高錳酸鉀溶液 B 用金屬鈉 C 測定沸點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是一套制取并驗證氯氣部分化學性質的實驗裝置。
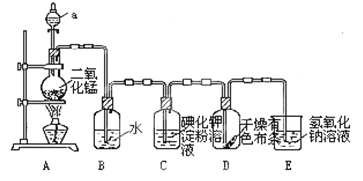
回答下列問題:反應的方程式:MnO2+4HCl(濃)![]() MnCl2+2H2O+ Cl2↑
MnCl2+2H2O+ Cl2↑
(1)裝置A中,儀器a盛有的試劑為___________。
(2)當Cl2氣流通過一段時間后,裝置B中溶液的pH值____7(填“>”“<”或“=”),寫出Cl2與水反應的方程式_______________________________________________
(3)當有少量Cl2氣流通過后,觀察到裝置C中的溶液變為______色。
(4)當Cl2氣流持續通過時,裝置D中干燥的有色布條能否褪色?為什么?
_______________________________________________________________。
(5)裝置E的作用是___________。并寫出該反應的化學方程式:________________。
(6)寫出氯氣與石灰乳制取漂白粉的化學方程式: ___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請回答下列問題:
(1)現有質量比為11:14的CO2和CO的混合氣體,則該混合氣體中的CO2和CO物質的量之比為_________,碳原子和氧原子的個數比為________ ,該混合氣體的摩爾質量為__________ 。
(2)12.4g含Na2X中含Na+0.4mol,則Na2X的摩爾質量是________ ,X的相對原子質量是____________。
(3)人造空氣(氧氣和氦氣的混合氣)可用于減輕某些疾病或供深水潛水員使用。在標準狀況下,11.2L人造空氣的質量是4.8g,其中氧氣和氦氣的分子數之比是_____________,氧氣的質量是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列敘述中正確的是( )
A. 11.2L氧氣與臭氧的混合氣體中含NA個氧原子
B. 60gSiO2晶體中含有2NA個Si—O鍵
C. 常溫下,20LpH=12的Na2CO3溶液中含有的OH-離子數為0.2NA
D. 標準狀況下,22.4LSO2的中心原子所含有的孤電子對數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
(1)如圖所示物質的有關結構,請回答:
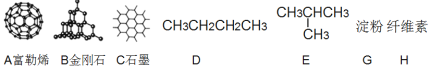
①A、B、C三者的關系為_________(填寫序號)。
a.同分異構體b.同素異形體c.同一種物質d.同位素
②固態時,A屬于__________晶體(填“離子”、“原子”或“分子”)。
③有同學認為D、E互為同分異構體而G、H兩者并不是同分異構體的關系。這句話正確嗎?答:__________(填寫“正確”或“不正確”)
④有機物E用系統命名法命名的名稱是__________。
(2)已知下列7種物質:a.P4(白磷) b.SiO2 c.NH4Cl d.NaOH e.NaCl f.干冰 g.金剛石,固態時它們都為晶體,回答下列問題:(填寫序號)
①晶體中既有離子鍵又有共價鍵的是__________
②熔化時只需要破壞共價鍵的是__________
③熔點最高的晶體是__________,沸點最低的晶體是__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器中,進行如下化學反應:N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化學平衡常數K與溫度t的關系如下表,完成下列問題。
2NH3(g) △H<0,其化學平衡常數K與溫度t的關系如下表,完成下列問題。
t/℃ | 25 | 125 | 225 | … |
K | 4.1×105 | K1 | K2 | … |
(1)該反應的化學平衡常數表達式為K=________;K1______K2(填“>”“<”或“=”);若增大壓強使平衡向正反應方向移動,則平衡常數_________(填“變”或“不變”)。
(2)判斷該反應達到化學平衡狀態的依據是____________(填序號):
A.2υH2(正)= 3υNH3(逆) B.混合氣體的密度保持不變
C.容器內壓強保持不變 D.N2的消耗速率等于H2的消耗速率
E.容器中氣體的平均相對分子質量不隨時間而變化 F.混合氣體的顏色保持不變
(3)將不同量的N2和H2分別通入到體積為2L的恒容密閉容器中,進行上述反應得到如下兩組數據:
實驗組 | 溫度(℃) | 起始量(mol) | 平衡量(mol) | 達到平衡所需時間(min) | |
N2 | H2 | NH3 | |||
1 | 650 | 2 | 4 | 0.9 | 9 |
2 | 900 | 1 | 2 | 0.3 | 0.01 |
實驗1中以υ(NH3)表示的反應速率為______,實驗2的速率比實驗1快的原因是____________;
(4)有人設計采用高性能質子導電材料SCY陶瓷(能傳遞H+),實現了常壓下既能合成氨又能發電的實驗裝置(如圖)。則其正極的電極反應為_____________。
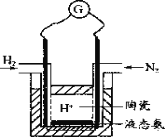
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在100 mL FeBr2溶液中通入標準狀況下2.24 L Cl2,溶液中有![]() 的Br-被氧化成單質Br2,則原FeBr2溶液中FeBr2的物質的量濃度為( )
的Br-被氧化成單質Br2,則原FeBr2溶液中FeBr2的物質的量濃度為( )
A.4 mol L-1B.![]() mol L-1C.
mol L-1C.![]() mol L-1D.
mol L-1D.![]() mol L-1
mol L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com