
分析 (1)電鍍是將鍍件與電源負極相連、鍍層與電源正極相連;
(2)①若用銅鹽進行化學鍍銅,陰極上銅離子得電子發生氧化反應,所以需要還原劑與之反應;
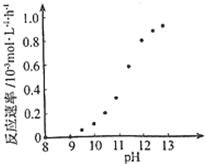
②根據圖知,溶液的pH越大反應速率越大,可以通過控制溶液pH控制反應速率;
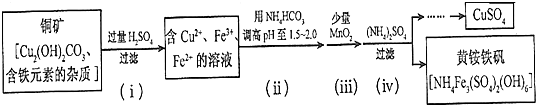
(3)銅礦中加入過量稀硫酸,發生的反應有Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,溶液中金屬陽離子有Cu2+、Fe2+、Fe3+,溶液呈酸性,加入碳酸氫銨,碳酸氫根離子和氫離子反應生成二氧化碳,從而增大溶液pH;向溶液中加入少量二氧化錳,酸性條件下,二氧化錳和亞鐵離子反應生成鐵離子、錳離子和水;向溶液中加入硫酸銨,硫酸銨和鐵離子反應生成沉淀NH4Fe3(SO4)2(OH)6,采用過濾方法分離沉淀和溶液,然后通過蒸發濃縮、冷卻結晶得到硫酸銅晶體,再結合題目分析解答.
解答 解:(1)電鍍是將鍍件與電源負極相連、鍍層與電源正極相連,故答案為:負;
(2)①若用銅鹽進行化學鍍銅,陰極上銅離子得電子發生氧化反應,所以需要還原劑與之反應,故答案為:還原劑;
②根據圖示信息,pH=8-9之間,反應速率為0,所以要使反應停止,調節溶液的pH至8-9 之間,故答案為:調節溶液的pH至8-9 之間;
(3)銅礦中加入過量稀硫酸,發生的反應有Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,溶液中金屬陽離子有Cu2+、Fe2+、Fe3+,溶液呈酸性,加入碳酸氫銨,碳酸氫根離子和氫離子反應生成二氧化碳,從而增大溶液pH;向溶液中加入少量二氧化錳,酸性條件下,二氧化錳和亞鐵離子反應生成鐵離子、錳離子和水;向溶液中加入硫酸銨,硫酸銨和鐵離子反應生成沉淀NH4Fe3(SO4)2(OH)6,采用過濾方法分離沉淀和溶液,然后通過蒸發濃縮、冷卻結晶得到硫酸銅晶體,
①堿式碳酸銅與硫酸反應生成硫酸銅、二氧化碳和水,反應方程式為Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,
故答案為:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;
②題目要求調高pH,銨根離子顯酸性,碳酸氫根離子顯堿性,則起作用的離子是碳酸氫根離子,故答案為;HCO3-;
③依題意亞鐵離子變成了鐵離子,1mol MnO2轉移電子2 mol,則錳元素從+4變成+2價,溶液是顯酸性的,方程式經過觀察可要補上氫離子,綜合上述分析可寫出離子方程式為MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案為:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
④濾后母液的pH=2.0,則c(H+)=0.01mol/L,c(Fe3+)=a mol•L-1,c(NH4+)=b mol•L-1,c(SO42-)=d mol•L-1,該反應的平衡常數K=$\frac{{c}^{6}({H}^{+})}{{c}^{3}(F{e}^{3+}).c(N{{H}_{4}}^{+}).{c}^{2}(S{{O}_{4}}^{2-})}$=$\frac{(0.01)^{6}}{{a}^{3}×b×p9vv5xb5^{2}}$=$\frac{1{0}^{-12}}{{a}^{3}bp9vv5xb5^{2}}$,
故答案為:$\frac{1{0}^{-12}}{{a}^{3}bp9vv5xb5^{2}}$.
點評 本題考查物質分離和提純的綜合應用及電解原理,側重考查學生分析能力,明確流程圖中發生的反應及分離方法是解本題關鍵,熟悉元素化合物性質及基本原理,難點是二氧化錳和亞鐵離子反應方程式的書寫,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯乙烷與NaOH溶液共熱,在水解后的溶液中加入硫酸,再加入AgNO3溶液檢驗Cl- | |
| B. | 將電石和水反應后的氣體通入溴水中,如果溴水褪色,證明乙炔和溴發生了反應 | |
| C. | 實驗室制溴苯時,將苯與液溴混合后加到有鐵絲的反應容器中 | |
| D. | 向苯酚濃溶液中滴入少量濃溴水可觀察到白色三溴苯酚沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
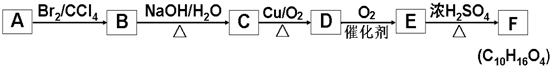
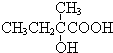
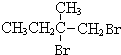 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$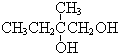 +2NaBr,反應類型取代反應
+2NaBr,反應類型取代反應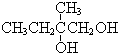 +O2+O2$\stackrel{催化劑}{→}$2
+O2+O2$\stackrel{催化劑}{→}$2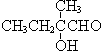 +2H2O,反應類型氧化反應
+2H2O,反應類型氧化反應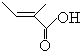 、
、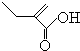 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3-CH2-COOH | B. | CH2=CH-CH2-OH | C. | CH2=CH-COOH | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:HCl>HI | B. | 原子半徑:Na>Mg | ||
| C. | 酸性:H2SO4>H2SO3 | D. | 結合質子能力:Cl->S2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 事實 | 推測 | |
| A | Mg與水反應緩慢,Ca與水反應較快 | Ba與水反應會更快 |
| B | Si是半導體材料,同族Ge也是半導體材料 | ⅣA族的元素都是半導體材料, |
| C | HCl在1500℃時分解,HI在230℃時分解 | HBr的分解溫度介于二者之間 |
| D | Si與H2高溫時反應,S與H2加熱能反應 | P與H2在高溫時能反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 新戊烷與氯氣在光照條件下的取代反應 | |
| B. | 乙烯與水在一定條件下的加成反應 | |
| C. | 乙醇在空氣中加熱(以銅作為催化劑)的氧化反應 | |
| D. | 苯與足量的氫氣在一定條件下的加成反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com