
【題目】硫酸錳廣泛應用于醫藥、食品、農藥、造紙等行業,如圖是以軟錳礦(主要成分是MnO2,還含有SiO2等雜質)和黃鐵礦(FeS2)制取MnSO4H2O的流程圖,已知Ksp(MnCO3)=2.2×10-11,氣體![]() 常用作氣體肥料。回答下列問題:
常用作氣體肥料。回答下列問題:
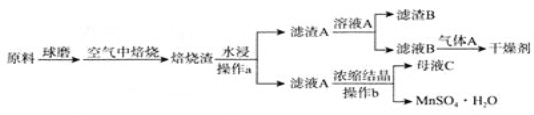
(1)空氣中高溫焙燒發生反應的化學方程式為________.
(2)氣體![]() 的電子式為________。
的電子式為________。
(3)操作a所用的主要玻璃儀器:________。
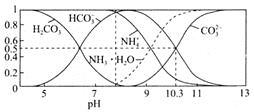
(4)常溫下,0.1mol/L碳酸氫銨溶液中微粒濃度分數與pH的關系如圖所示,取一定量母液C加入NH4HCO3至其濃度為0.1mol/L可制得高性能強磁性材料MnCO3,該反應的離子方程式為________![]() 同時調pH=10.3,則溶液中c(Mn2+)=________.
同時調pH=10.3,則溶液中c(Mn2+)=________.
(5)硫酸錳是工業制備MnO2電極的活性原料,則用惰性電極電解酸性母液C制得MnO2的陽極電極反應式為________![]() 若電路中通過0.3mol電子時,理論上得到MnO2的質量為________g。
若電路中通過0.3mol電子時,理論上得到MnO2的質量為________g。
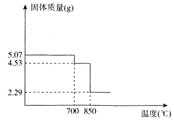
(6)如圖是MnSO4H2O的熱重曲線,則850℃時固體化學式為________.700℃時發生反應的化學方程式是________.
【答案】4FeS2+11O2+8MnO2![]() 2Fe2O3+3MnSO4
2Fe2O3+3MnSO4 ![]() 燒杯、漏斗、玻璃棒 Mn2++2HCO3-=MnCO3+CO2↑+H2O 4.4×10-10mol/L Mn2+-2e-+2H2O=MnO2+4H+ 13.05 Mn3O4 MnSO4H2O
燒杯、漏斗、玻璃棒 Mn2++2HCO3-=MnCO3+CO2↑+H2O 4.4×10-10mol/L Mn2+-2e-+2H2O=MnO2+4H+ 13.05 Mn3O4 MnSO4H2O![]() MnSO4+H2O↑
MnSO4+H2O↑
【解析】
(1)由流程圖可知:Mn元素存在于溶液中,最后結晶出MnSO4H2O,故空氣中高溫焙燒時MnO2參加了反應;
(2)CO2電子式為![]() ;
;
(3)操作a為過濾操作;
(4)母液C中溶質為MnSO4加入NH4HCO3生成MnCO3;由圖象可知,pH=10.3,c(HCO3-)=c(CO32-)= 0.05mol/L;
(5)根據Mn2+-2e-+2H2O=MnO2+4H+計算;
(6)由MnSO4H2O熱重曲線可知,利用質量差,推測物質。
(1)由流程圖可知:Mn元素存在于溶液中,最后結晶出MnSO4H2O,故空氣中高溫焙燒時MnO2參加了反應,其發生反應的化學方程式為4FeS2+11O2+8MnO2![]() 2Fe2O3+3MnSO4;
2Fe2O3+3MnSO4;
(2)CO2為氣體肥料,其電子式為![]() ;
;
(3)操作a為過濾操作,故所用的主要玻璃儀器:燒杯、漏斗、玻璃棒;
(4)母液C中溶質為MnSO4加入NH4HCO3生成MnCO3,故反應的離子方程式為Mn2++2HCO3-=MnCO3+CO2↑+H2O;由圖象可知,pH=10.3,c(HCO3-)=c(CO32-)= 0.05mol/L,則溶液中c(Mn2+)=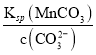 =
=![]() =4.4×10-10mol/L;
=4.4×10-10mol/L;
(5)惰性電極電解酸性硫酸錳溶液制得MnO2的陽極電極反應式為Mn2+-2e-+2H2O=MnO2+4H+;當電路中通過0.3mol電子時,理論上得到MnO2的質量為0.3×0.5×87=13.05g;
(6)由MnSO4H2O熱重曲線可知,MnSO4H2O晶體的起始物質的量為![]() =0.03mol,當700℃時固體質量減少量為5.07g-4.53g=0.54g,可知減少的H2O的物質的量為0.03mol,則發生的反應為MnSO4H2O
=0.03mol,當700℃時固體質量減少量為5.07g-4.53g=0.54g,可知減少的H2O的物質的量為0.03mol,則發生的反應為MnSO4H2O![]() MnSO4+H2O↑;850℃時固體質量為2.29g,其中錳元素的質量為0.03×55=1.65g,氧原子的物質的量為
MnSO4+H2O↑;850℃時固體質量為2.29g,其中錳元素的質量為0.03×55=1.65g,氧原子的物質的量為![]() =0.04mol,Mn原子與O原子個數比為3:4,則固體的化學式為Mn3O4。
=0.04mol,Mn原子與O原子個數比為3:4,則固體的化學式為Mn3O4。


科目:高中化學 來源: 題型:
【題目】已知反應A2(g) + 2B2(g)![]() 2AB2(g) ΔH < 0,列說法正確的是 ( )
2AB2(g) ΔH < 0,列說法正確的是 ( )
A.升高溫度,正向反應速率增加,逆向反應速率減小
B.達到平衡后,降低溫度或減小壓強都有利于該反應平衡正向移動
C.達到平衡后,升高溫度或增大壓強都有利于該反應平衡正向移動
D.升高溫度有利于反應速率增加,從而縮短達到平衡的時間
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】成熟的蘋果中含有淀粉、葡萄糖和無機鹽等,某課外興趣小組設計了一組實驗證明某些成分的存在,請你參與并協助他們完成相關實驗。
(1)用小試管取少量的蘋果汁,加入_______(填名稱),溶液變藍,則證明蘋果中含有淀粉。
(2)利用含淀粉的物質可以生產醋酸。下面是生產醋酸的流程圖,試回答下列問題:
![]()
B是日常生活中有特殊香味的常見有機物,在有些飲料中含有B。
①寫出化學方程式,并注明反應類型。
B與醋酸反應:____________________________,屬于______________反應。
B→C____________________________,屬于____________________________反應。
②可用于檢驗A的試劑是____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸(H2C2O4,二元弱酸)與草酸鹽在實驗和工業生產中都起著重要的作用。
(1)硫酸酸化的KMnO4能與Na2C2O4溶液反應生成Mn2+和CO2,該反應的離子方程式為__________;
(2)分別使10 mL pH=3的H2C2O4溶液和100 mL pH=4的H2C2O4溶液全部轉化為Na2C2O4,所需等濃度的NaOH溶液的體積為V1和V2,則V1_____V2(填“>”“<”或“=”)
(3)常溫下,用0.1000 mol/L NaOH溶液滴定20.00 mL某未知濃度的H2C2O4溶液,滴定曲線如圖,c點所示溶液中:![]()
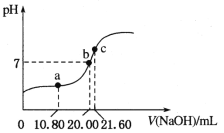
①該草酸溶液的物質的量濃度為__________;
②a點所示溶液中各離子的濃度由大到小的順序為_________________;
(4)已知:某溫度時,Ksp(FeC2O4)=2.0×10-7,Ksp(CaC2O4)=2.5×10-9。
①此溫度下,CaC2O4飽和溶液的物質的量濃度為________;
②此溫度下,向Na2C2O4溶液中加入FeCl2與CaCl2,當兩種沉淀共存時,溶液中c(Fe2+):c(Ca2+)=_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,將3 mol A和1 mol B兩種氣體混合于固定容積為2 L的密閉容器中,發生如下反應:3A(g)+B(g) ![]() xC(g)+2D(g)。2 min末該反應達到平衡,生成0.8 mol D,并測得C的濃度為0.8 mol·L-1。下列判斷錯誤的是( )
xC(g)+2D(g)。2 min末該反應達到平衡,生成0.8 mol D,并測得C的濃度為0.8 mol·L-1。下列判斷錯誤的是( )
A. x=4 B. 2 min內B的反應速率為0.1 mol·(L·min)-1
C. 混合氣體密度不變,則表明該反應已達到平衡狀態 D. B的轉化率為40%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化鍺(GeO2)可用于制備半導體材料,某實驗小組以鐵礬渣(主要成分為FeO、CaO、GeO和SiO2等)為原料制取二氧化鍺的工藝流程如下所示。
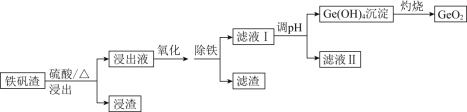
已知:25℃時,部分金屬陽離子轉化為氫氧化物沉淀時的pH如下表所示。
離子 | Fe3+ | Mn2+ | Ge4+ |
開始沉淀時的pH | 2.3 | 8.3 | 8.2 |
沉淀完全時的pH | 4.1 | 9.8 | 11.2 |
請回答下列問題:
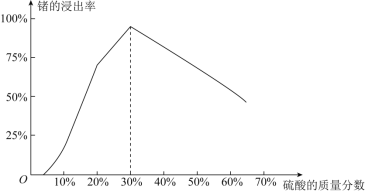
(1)由下圖可知,“浸出”時,所用硫酸的最佳質量分數為________,浸渣的主要成分為________________(填化學式)。
(2)“氧化”時,可選用的試劑為________(填字母)。
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”時,若以適量稀硝酸作氧化劑,則Ge2+被氧化的離子方程式為________________。“氧化”后,選用K3[Fe(CN)6]溶液證明Fe2+已全部被氧化的實驗現象為________________________________________________。
(4)“除鐵”時,可選用Na2CO3為除鐵劑,其原理為____________________________。
(5)已知Ge(OH)4,具有兩性,在得到Ge(OH)4的過程中,若溶液的pH大于12,會導致Ge(OH)4溶解,寫出該反應的離子方程式:________________________________。
(6)利用惰性電極電解酸性GeSO4溶液也可制得GeO2,則陽極的電極反應式為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制乙酸乙酯的主要裝置如圖所示:
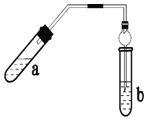
主要步驟:
①在 a 試管中 按 2:3:2 的體積比配制濃硫酸、乙醇、乙酸的混合物;
②按 A 圖連接裝置,使產生的蒸氣經導管通到 b 試管所盛的飽和碳酸鈉溶液中;
③小火加熱 a 試管中 的混合液;
④等 b 試管中收集到約 2mL 產物時停止加熱。撤下 b 試管并用力振 蕩,然后靜置待其中液體分層;
⑤分離出純凈的乙酸乙酯。
請回答下列問題:
⑴實驗室配制混合物加入試劑順序:______。
⑵步驟![]() 中可觀察到 b 試管中有細小的氣泡冒出,寫出該反應的離子方程式:______。
中可觀察到 b 試管中有細小的氣泡冒出,寫出該反應的離子方程式:______。
⑶A 裝置中使用球形干燥管除起到冷凝作用外,另一重要作用是______,步驟![]() 中分離乙 酸乙酯必須使用的一種儀器是______。
中分離乙 酸乙酯必須使用的一種儀器是______。
⑷為證明濃硫酸在該反應中起到了催化劑和吸水劑的作用,某同學利用圖 A 所示裝置進行了以下 4 個實驗。實驗開始先用酒精燈微熱 3min,再加熱使之微微沸騰 3min。實驗結束后充分振蕩小試管 b 再測 有機層的厚度,實驗記錄如下:
實驗編號 | 試管 a 中試劑 | 試管 b 中試劑 | 測得有機層的厚度/cm |
W | 3mL 乙醇、2mL 乙酸、2mL 18mol/L 濃硫酸 | 飽和 Na2CO3 溶液 | 5.0 |
X | 3mL 乙醇、2mL 乙酸 | 0.1 | |
Y | 3mL 乙醇、2mL 乙酸、2mL3mol/LH2SO4 | 1.2 | |
Z | 3mL 乙醇、2mL 乙酸、鹽酸 | 1.2 |
①實驗 Y 的目的是與實驗 Z 相對照,證明H+ 對酯化反應具有催化作用。實驗 Z 中應加入鹽酸的體積 和濃度分別是______mL 和______mol/L
②分析實驗______![]() 填實驗編號
填實驗編號![]() 的數據,可以推測出濃H2SO4 的吸水性提高了乙酸乙酯的產率。 濃硫酸的吸水性能夠提高乙酸乙酯產率的原因是______。
的數據,可以推測出濃H2SO4 的吸水性提高了乙酸乙酯的產率。 濃硫酸的吸水性能夠提高乙酸乙酯產率的原因是______。
③加熱有利于提高乙酸乙酯的產率,但實驗發現溫度過高乙酸乙酯的產率反而降低,可能的原因是______
④分離出乙酸乙酯層后,經過洗滌,為了干燥乙酸乙酯可選用的干燥劑為______![]() 填字母
填字母![]() 。
。
A.P2O5 B.無水Na2SO4 C.堿石灰 D.NaOH 固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高錳酸鉀是錳的重要化合物和常用的氧化劑。以下是工業上用軟錳礦制備高錳酸鉀的一種工藝流程:
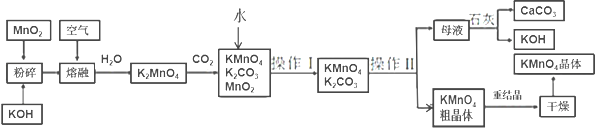
(1)KMnO4稀溶液是一種常用的消毒劑。其消毒原理與下列________________物質相似。
a.75%酒精 b.雙氧水 c.苯酚 d.“84”消毒液(NaClO溶液)
(2)粉碎的目的是________________,操作Ⅰ的名稱是________________
(3)上述流程中可以循環使用的物質有石灰、CO2、_________和__________(寫化學式)。
(4)向K2MnO4溶液中通入CO2以制備KMnO4,該反應中的還原劑是____________。
(5)鉍酸鈉(NaBiO3,不溶于水)用于定性檢驗酸性溶液中Mn2+的存在(鉍元素的還原產物為Bi3+,Mn的氧化產物為+7價),寫出反應的離子方程式:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應在生產生活中有著重要的應用。請按要求寫出相應的方程式。
(1)ClO2是一種高效安全的殺菌消毒劑。氯化鈉電解法生產ClO2工藝原理示意圖如下:
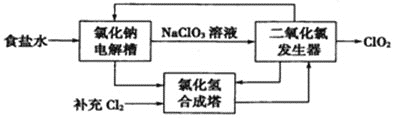
①寫出氯化鈉電解槽內發生反應的離子方程式:________________________。
②寫出ClO2發生器中的化學方程式,并標出電子轉移的方向及數目:_____________。
(2)甲醇燃料電池是采用鉑作電極催化劑,其工作原理的示意圖如下:
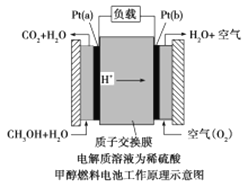
請回答下列問題:
Pt(a)電極是電池的_______極,電極反應式為______________________;
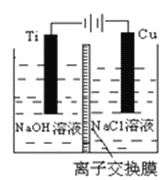
(3)方法Ⅱ采用離子交換膜控制電解液中OH-的濃度而制備納米Cu2O,裝置如圖所示,該電池的陽極反應式為______________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com