
【題目】草酸(H2C2O4,二元弱酸)與草酸鹽在實驗和工業生產中都起著重要的作用。
(1)硫酸酸化的KMnO4能與Na2C2O4溶液反應生成Mn2+和CO2,該反應的離子方程式為__________;
(2)分別使10 mL pH=3的H2C2O4溶液和100 mL pH=4的H2C2O4溶液全部轉化為Na2C2O4,所需等濃度的NaOH溶液的體積為V1和V2,則V1_____V2(填“>”“<”或“=”)
(3)常溫下,用0.1000 mol/L NaOH溶液滴定20.00 mL某未知濃度的H2C2O4溶液,滴定曲線如圖,c點所示溶液中:![]()
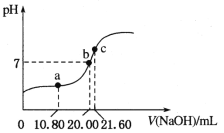
①該草酸溶液的物質的量濃度為__________;
②a點所示溶液中各離子的濃度由大到小的順序為_________________;
(4)已知:某溫度時,Ksp(FeC2O4)=2.0×10-7,Ksp(CaC2O4)=2.5×10-9。
①此溫度下,CaC2O4飽和溶液的物質的量濃度為________;
②此溫度下,向Na2C2O4溶液中加入FeCl2與CaCl2,當兩種沉淀共存時,溶液中c(Fe2+):c(Ca2+)=_____。
【答案】2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O > 0.054 mol/L c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 5×10-5 mol/L 80
【解析】
(1)根據KMnO4能與熱的經硫酸化的Na2C2O4反應生成Mn2+和CO2,并利用質量守恒定律、電荷守恒、電子守恒來書寫離子反應方程式;
(2)相同溫度下,酸的濃度越小其電離程度越大,草酸和堿反應消耗堿的物質的量與酸的物質的量成正比;
(3)①用0.1000 mol/LNaOH溶液滴定20.00 mL某未知濃度的H2C2O4溶液,根據c點離子濃度之間的關系,得到c點的溶液是草酸鈉的水溶液,根據滴定原理來計算;
②a點所示溶液顯示酸性,此時得到的是草酸氫鈉溶液,據此回答;
(5)①根據Ksp的意義結合物質的量濃度公式c=![]() 來計算;
來計算;
②根據Ksp表達式得到溶液中c(Fe2+):c(Ca2+)等于Ksp(FeC2O4):Ksp(CaC2O4),據此計算。
由KMnO4能與熱的經硫酸化的Na2C2O4反應生成MnSO4和CO2,反應的化學方程式為2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,根據物質拆分原則,其離子方程式是:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O;
(2)相同溫度下,酸的濃度越小其電離程度越大,所以pH=3草酸的濃度大于pH=4草酸濃度的10倍,10 mLpH=3的草酸溶液和100 mLpH=4的草酸溶液,前者的物質的量大于后者,草酸和堿反應消耗堿的物質的量與酸的物質的量成正比,所以消耗氫氧化鈉體積V1>V2;
(3)①用0.100 mol/LNaOH溶液滴定20.00 mL某未知濃度的H2C2O4溶液,根據c點離子濃度之間的關系,得到c點的溶液是草酸鈉的水溶液,草酸和氫氧化鈉之間按照1:2物質的量之比進行反應,所以該草酸溶液的物質的量濃度c(H2C2O4)=![]() ≈0.054 mol/L;
≈0.054 mol/L;
②c點為Na2C2O4溶液,此時NaOH溶液的體積是21.60 mL,而a點時NaOH溶液的體積是10.80 mL,恰好是c點消耗的一半,則a點溶液為NaHC2O4溶液;所示溶液顯示酸性,說明HC2O4-電離程度大于其水解程度,且溶液中同時存在水電離產生H+,且HC2O4-電離程度遠大于水的電離程度,則c(H+)>c(C2O42-)>c(OH-);HC2O4-由于電離、水解消耗,而溶液中Na+不發生任何變化,鹽電離產生的離子濃度遠大于其電離產生的微粒濃度,所以c(Na+)>c(HC2O4-)>c(H+),故溶液中各離子的濃度由大到小的順序為c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)①已知Ksp(CaC2O4)=2.5×10-9,假設飽和溶液濃度是x,則根據溶度積常數的含義可知Ksp=c(Ca2+)c(C2O42-)=x2=2.5×10-9=25×10-10,所以x=5×10-5 mol/L,溶液的體積是1 L,所溶解的草酸鈣的物質的量是5×10-5mol;
②此溫度下,向Na2C2O4溶液中加入FeCl2與CaCl2,當兩種沉淀共存時,溶液c(Fe2+):c(Ca2+)等于Ksp(FeC2O4):Ksp(CaC2O4)=![]() =80。
=80。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化學 來源: 題型:
【題目】二硫化鎢(WS2,WS2中W的化合價為+4)可用作潤滑劑及石油化工領域中的催化劑。由鎢鐵礦(其主要成分是FeWO4,還含少量Al2O3)制備二硫化鎢的工藝流程如下:
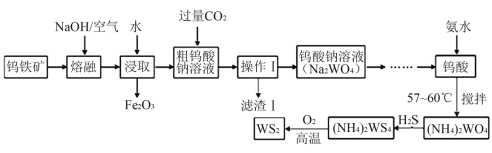
請回答下列問題:
(1)“濾渣Ⅰ”的化學式為__________;
(2)提高“熔融”速率的措施有_____________________(寫一條即可);
(3)用離子方程式表示通入過量CO2的主要目的是:________________________;
(4)鎢酸與氨水反應時控制溫度為58℃,溫度不宜太高,其原因是___________。
(5)已知2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,若該反應轉移了8 mol電子,則生成的氣體產物在標準狀況下的體積為______L;
2WS2+4NH3+2S+2SO2+2H2O,若該反應轉移了8 mol電子,則生成的氣體產物在標準狀況下的體積為______L;
(6)常溫下,Ksp(CaWO4) =1×10-10。在鎢酸鈉溶液中滴加澄清石灰水產生鎢酸鈣沉淀,當溶液中pCa=-1g c(Ca2+)=4,c(WO42-)=_____mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)水的電離平衡曲線如圖所示,若A點表示25 ℃時水的電離達平衡時的離子濃度,B點表示100 ℃時水的電離達平衡時的離子濃度。則100 ℃時pH=12的NaOH溶液100mL,要使它的pH為11。(體積變化忽略不計)
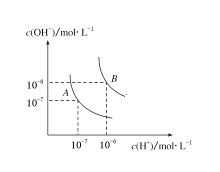
①如果加入蒸餾水,應加_________mL;
②如果加入pH=10的NaOH溶液,應加_________mL;
(2)25 ℃時,向水的電離平衡體系中加入少量NH4Cl固體,對水的電離平衡的影響是________(填“促進”、 “抑制”或“不影響”)。
已知如表數據。
化學式 | 電離平衡常數(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃時,有等濃度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三種溶液的pH由大到小的順序為_________。(填化學式)
(4)25 ℃時,等濃度的CH3COOH溶液和NaOH溶液等體積混合,所得溶液顯堿性,則c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反應的化學方程式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中山大學中山醫學院顏光美教授課題組發現一種叫![]() 的天然病毒(屬于蛋白質),其能殺死癌細胞而不傷害正常細胞,該病毒含有C、H、O、N、S等元素,其直徑大約為
的天然病毒(屬于蛋白質),其能殺死癌細胞而不傷害正常細胞,該病毒含有C、H、O、N、S等元素,其直徑大約為![]() 。下列說法不正確的是( )。
。下列說法不正確的是( )。
A.![]() 病毒中的C、H、O、N、S原子最有可能以共價鍵結合
病毒中的C、H、O、N、S原子最有可能以共價鍵結合
B.![]() 病毒不屬于高分子化合物
病毒不屬于高分子化合物
C.![]() 病毒溶于水形成的液體具有丁達爾效應
病毒溶于水形成的液體具有丁達爾效應
D.![]() 病毒在生物體內的水解產物可能是氨基酸
病毒在生物體內的水解產物可能是氨基酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)有一種燃料電池,所用燃料為H2和空氣,電解質為熔融的K2CO3。回答下列問題
①CO![]() 移向____________極。
移向____________極。
②正極反應式為____________________。
③電池中CO![]() 的物質的量將逐漸________________(填增大、減少、不變)。
的物質的量將逐漸________________(填增大、減少、不變)。
(2)用上面的電池對下物質進行電解,其中a、b、c、d、e、f電極均為惰性電極,通電后,a極產生的氣體明顯多于b極,2分鐘后,測得乙池的pH為12,則
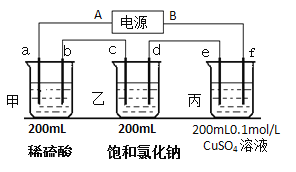
①電源A極是______________極。
②c極上的電極反應式:___________________。
③甲、乙兩池共可收集到________mol氣體。
④丙裝置上某極可析出固體________克,溶液的pH為________________。(常溫,不考慮溶液體積變化)
⑤電解n分鐘后,硫酸銅正好消耗完,再將e、f電極反接電源,用同樣的電流再電解n分鐘,則丙溶液中的硫酸銅的物質的量濃度為______________mol/L。(不考慮溶液體積變化)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:X(s)+Y(g)![]() 2Z(g)在容積為1L密閉容器反應,下列敘述不是反應達到平衡狀態的標志的是
2Z(g)在容積為1L密閉容器反應,下列敘述不是反應達到平衡狀態的標志的是
①單位時間內生成1molX的同時消耗2molZ ②Z的體積分數不再變化
③體系的壓強不再改變 ④Y、Z的物質的量濃度比為1:2
⑤Y的轉化率不再改變的狀態 ⑥混合氣體的密度不再改變的狀態
A. 僅①④ B. ①③④ C. ①④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸錳廣泛應用于醫藥、食品、農藥、造紙等行業,如圖是以軟錳礦(主要成分是MnO2,還含有SiO2等雜質)和黃鐵礦(FeS2)制取MnSO4H2O的流程圖,已知Ksp(MnCO3)=2.2×10-11,氣體![]() 常用作氣體肥料。回答下列問題:
常用作氣體肥料。回答下列問題:
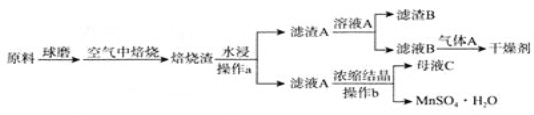
(1)空氣中高溫焙燒發生反應的化學方程式為________.
(2)氣體![]() 的電子式為________。
的電子式為________。
(3)操作a所用的主要玻璃儀器:________。
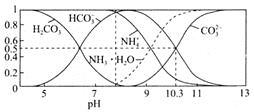
(4)常溫下,0.1mol/L碳酸氫銨溶液中微粒濃度分數與pH的關系如圖所示,取一定量母液C加入NH4HCO3至其濃度為0.1mol/L可制得高性能強磁性材料MnCO3,該反應的離子方程式為________![]() 同時調pH=10.3,則溶液中c(Mn2+)=________.
同時調pH=10.3,則溶液中c(Mn2+)=________.
(5)硫酸錳是工業制備MnO2電極的活性原料,則用惰性電極電解酸性母液C制得MnO2的陽極電極反應式為________![]() 若電路中通過0.3mol電子時,理論上得到MnO2的質量為________g。
若電路中通過0.3mol電子時,理論上得到MnO2的質量為________g。
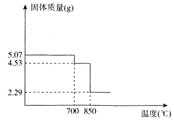
(6)如圖是MnSO4H2O的熱重曲線,則850℃時固體化學式為________.700℃時發生反應的化學方程式是________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組性質比較中,正確的是()
①沸點:![]()
②離子還原性:![]()
③酸性:![]()
④金屬性:![]()
⑤氣態氫化物穩定性:![]()
⑥半徑:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E、F、G都是元素周期表中前四周期的元素,它們的原子序數依次增大。A是宇宙中含量最豐富的元素,B、D原子的L層有2個未成對電子。E3+離子M層3d軌道電子為半滿狀態,F比E原子序數大1且位于同一族,G的最外層只有1個電子。請根據以上情況,回答下列問題:(答題時,用所對應的元素符號表示)
(1)寫出E的電子排布式____________,E位于周期表____區。
(2)B、C、D的第一電離能由小到大的順序為___________。
(3)A、B、D三種元素可以形成組成為A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 雜化的是_________(填結構簡式)
(4)![]() 的空間構型為___________,鍵角為_______。
的空間構型為___________,鍵角為_______。
(5)F可形成分子式均為F(NH3)5BrSO4的兩種配合物,其中一種化學式為[F(NH3)5Br]SO4往其溶液中加BaCl2溶液時,現象是_______;往另一種配合物的溶液中加入BaCl2溶液時,無明顯現象,若加入AgNO3溶液時產生淡黃色沉淀,則第二種配合物的化學式為_______
(6)B元素在自然界有多種同素異形體,硬度最大晶體中每個晶胞中平均含有___個B原子。若晶胞的棱長為acm,則它的密度為____g/cm3(NA表示阿伏加德羅常數)
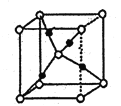
(7)G的一種氧化物M的晶胞結構如圖所示(小圓圈代表氧原子),則M的化學式為________,該晶體中氧原子的配位數為_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com