
| 化學鍵 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
分析 (1)N2H4結合H2O電離的氫離子使溶液呈堿性;
(2)反應熱=反應物總鍵能-生成物總鍵能;
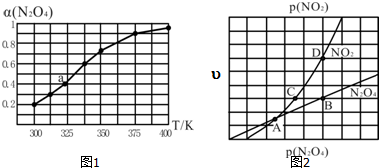
(3)①升高溫度平衡向吸熱方向移動;減小體系壓強、移出NO2都使平衡正向移動;
②化學平衡常數K=$\frac{生成物分壓冪之積}{反應物分壓冪之積}$;
③化學平衡常數Kp=[p(NO2)]2÷p(N2O4),二者的反應速率之比等于其計量數之比;滿足平衡條件υ(NO2)=2υ(N2O4)即為平衡點.
解答 解:(1)肼易溶于水,它是與氨類似的弱堿,則電離生成OH-和陽離子,電離方程式為N2H4+H2O?N2H+5+OH-,
故答案為:N2H4+H2O?N2H+5+OH-;
(2)設1mol N2O4(1)完全分解成相應的原子時需要吸收的能量QKJ,則:
190kJ/mol×2+390kJ/mol×8+QkJ/mol-946kJ/mol×3-460kJ/mol×8=-1225 kJ/mol,
解得Q=1793,
故答案為:1793kJ;
(3)①根據圖知,升高溫度轉化率增大,升高溫度平衡向吸熱方向移動,則正反應是吸熱反應,若要提高N2O4轉化率,除改變反應溫度外,其他措施有減小體系壓強、移出NO2,
故答案為:>; 溫度升高,α(N2O4)增加,說明平衡右移,該反應為吸熱反應,△H>0;減小體系壓強(或移出NO2等);
②四氧化二氮的轉化率是0.4,設原來四氧化二的物質的量為xmol,轉化的物質的量為0.8xmol,則混合氣體的物質的量=(x-0.4x+0.8x)mol=1.4xmol,相同條件下,氣體的壓強之比等于其物質的量之比,所以反應后壓強=$\frac{108KPa}{xmol}$=151.2KPa,
四氧化二氮的分壓=151.2KPa×$\frac{0.6xmol}{1.4xmol}$=64.8KPa,
二氧化氮的分壓=151.2KPa×$\frac{0.8xmol}{1.4xmol}$=86.4KPa,
化學平衡常數K=$\frac{生成物分壓冪之積}{反應物分壓冪之積}$=$\frac{86.{4}^{2}}{64.8}$=115.2,
故答案為:115.2;
③化學平衡常數Kp=[p(NO2)]2÷p(N2O4),二者的反應速率之比等于其計量數之比,
所以υ(NO2):υ(N2O4)=k2[p(NO2)]2:k1•p(N2O4)=2:1,
化學平衡常數Kp=[p(NO2)]2÷p(N2O4),
則K1=$\frac{1}{2}$K2.Kp,
滿足平衡條件υ(NO2)=2υ(N2O4)即為平衡點,BD點的壓強之比等于其反應速率之比為1:2,所以BD為平衡點,
故答案為:$\frac{1}{2}$K2.Kp;B點與D點;滿足平衡條件υ(NO2)=2υ(N2O4).
點評 本題考查化學平衡有關計算、化學平衡影響移動、反應熱計算等,是對學生綜合能力的考查,難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | AgCl在飽和NaCl溶液中的Ksp比在純水中的Ksp小 | |
| B. | 向AgCl的懸濁液中滴加濃氨水,沉淀溶解,說明AgCl的溶解平衡向右移動 | |
| C. | 將0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先產生Ag2CrO4沉淀 | |
| D. | 向AgCl的懸濁液中加入NaBr溶液,白色沉淀轉化為淡黃色,說明Ksp(AgCl)<Ksp(AgBr) |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
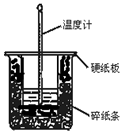 50mL 0.50mol•L-1鹽酸與50mL 0.55mol•L-1NaOH溶液在圖示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列題:
50mL 0.50mol•L-1鹽酸與50mL 0.55mol•L-1NaOH溶液在圖示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3個 | B. | 4個 | C. | 5個 | D. | 6個 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 從海帶中提取單質碘及碘的化合物間的轉化關系如圖所示:
從海帶中提取單質碘及碘的化合物間的轉化關系如圖所示:
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 汽車尾氣是城市的主要空氣污染物,研究控制汽車尾氣成為保護環境的首要任務.
汽車尾氣是城市的主要空氣污染物,研究控制汽車尾氣成為保護環境的首要任務. .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com