某化學課外興趣小組為探究銅跟濃硫酸的反應情況,用下圖所示裝置先進行了有關實驗:
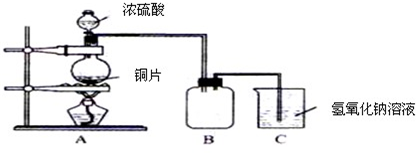
(1)B是用來收集實驗中產生的氣體的裝置,但未將導管畫全,請在圖上把導管補充完整.
(2)實驗中他們取6.4g 銅片和12mL 18mol?L
-1濃硫酸放在圓底燒瓶中共熱,直到反應完畢,最后發現燒瓶中還有銅片剩余,該小組學生根據所學的化學知識認為還有一定量的硫酸剩余.
①寫出銅跟濃硫酸反應的化學方程式:
Cu+2H
2SO
4(濃)
CuSO
4+SO
2↑+2H
2O
Cu+2H
2SO
4(濃)
CuSO
4+SO
2↑+2H
2O
;
②為什么有一定量的余酸但未能使銅片完全溶解,你認為原因是
隨著反應進行,硫酸被消耗,產物有水生成,所以濃硫酸變成稀硫酸,反應會停止
隨著反應進行,硫酸被消耗,產物有水生成,所以濃硫酸變成稀硫酸,反應會停止
;
③下列藥品中能夠用來證明反應結束后的燒瓶中確有余酸的是:
AD
AD
(填寫編號).
A.鐵粉 B.氯化鋇溶液 C.銀粉 D.碳酸氫鈉溶液
(3)為定量測定余酸的物質的量濃度,甲學生進行了如下設計學生設計的方案是:在反應后的溶液中加蒸餾水稀釋至1000mL,取20mL與錐形瓶中,滴入2~3滴甲基橙指示劑,用標準氫氧化鈉溶液進行滴定(已知氫氧化銅開始沉淀的pH約為5),通過測出消耗氫氧化鈉溶液的體積來求余酸的物質的量濃度.假定反應前后燒瓶中溶液的體積不變,你認為他設計的實驗方案能否求得余酸的物質的量濃度
不能
不能
(填“能”或“不能”),其理由是
雖然甲基橙變色范圍:pH為3.1~4.4,氫氧化銅開始沉淀時的pH為5,在指示劑變色范圍之外,即中和酸時,銅離子不會消耗OH-,但是甲基橙由紅色變成橙色、黃色時,銅離子溶液呈藍色,對觀察指示終點顏色有干擾
雖然甲基橙變色范圍:pH為3.1~4.4,氫氧化銅開始沉淀時的pH為5,在指示劑變色范圍之外,即中和酸時,銅離子不會消耗OH-,但是甲基橙由紅色變成橙色、黃色時,銅離子溶液呈藍色,對觀察指示終點顏色有干擾
.
(4)現已確認,SO
2和NOx的排放是造成酸沉降的兩大罪魁禍首.汽車排放的尾氣中含有未燃燒充分的CH、以及N
2、CO
2、NO、CO等.有人設計利用反應2NO+2CO

N
2+2CO
2 將有害的污染物轉化為可參與大氣循環的N
2和CO
2.
在某溫度下用氣體傳感器測得不同時間的NO和CO濃度如表:
| 時間/h |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/mol?L-1 |
1.00×10-3 |
4.5×10-4 |
2.5×10-4 |
1.5×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/mol?L-1 |
3.6×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
在上述條件下反應能夠自發進行,則反應的△H
<
<
0(“>”、“<”、“=”).前2h內的平均反應速率v(N
2)=
1.875×10-4mol?L-1?h-1
1.875×10-4mol?L-1?h-1
,在該溫度下,反應的平衡常數K=
5000
5000
.據此你認為將該反應從理論轉化為現實的最重要的研究方向是
尋找高效的催化劑
尋找高效的催化劑
.



 N2+2CO2 將有害的污染物轉化為可參與大氣循環的N2和CO2.
N2+2CO2 將有害的污染物轉化為可參與大氣循環的N2和CO2.