
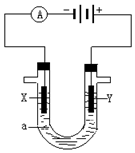
 人們習慣上把電解飽和食鹽水的工業叫做氯堿工業.
人們習慣上把電解飽和食鹽水的工業叫做氯堿工業.分析 電解飽和食鹽水時,由電源可知,X為陰極,Y為陽極,陽極上是氯離子失電子生成氯氣,氯氣具有氧化性,可用淀粉碘化鉀檢驗,陰極上是氫離子得電子生成氫氣,同時生成氫氧化鈉,呈堿性,以此解答該題.
解答 解:①和電源的負極相連的電極X極是陰極,該電極上氫離子發生得電子的還原反應,即2H++2e-=H2↑,在X極附近觀察到的現象是放出氣體,溶液變紅,
故答案為:2H++2e-═H2↑;放出氣體,溶液變紅;
②和電源的正極相連的電極Y極是陽極,該電極上氯離子發生失電子的氧化反應,即2Cl--2e-=Cl2↑,檢驗氯氣的方法是把濕潤的淀粉碘化鉀試紙放在Y電極附近,試紙變藍色,
故答案為:2Cl--2e-═Cl2↑;把濕潤的淀粉碘化鉀試紙放在Y電極附近,試紙變藍色;
③電解氯化鈉溶液得到氯氣、氫氣和氫氧化鈉,離子方程式為2Cl-+2H2O $\frac{\underline{\;電解\;}}{\;}$ Cl2↑+H2↑+2OH-,
故答案為:2Cl-+2H2O $\frac{\underline{\;電解\;}}{\;}$ Cl2↑+H2↑+2OH-.
點評 本題考查學生電解池的工作原理知識,為高頻考點,明確圖中電源的正負極確定電解池的陰陽極是解答的關鍵,并熟悉電極反應及離子的放電順序來解答,題目難度中等.


 中考利劍中考試卷匯編系列答案
中考利劍中考試卷匯編系列答案 教育世家狀元卷系列答案
教育世家狀元卷系列答案 黃岡課堂作業本系列答案
黃岡課堂作業本系列答案 單元加期末復習先鋒大考卷系列答案
單元加期末復習先鋒大考卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在已知元素中具有最大的原子半徑 | B. | 其單質的熔點比金屬鈉的熔點高 | ||
| C. | 氧化物對應的水化物是極強的堿 | D. | 金屬鈁與氧氣或水反應非常劇烈 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
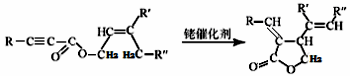 (R、R‘、R“表示氫、烷基或芳基)
(R、R‘、R“表示氫、烷基或芳基)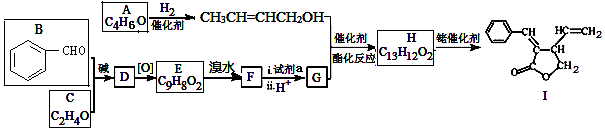
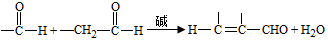
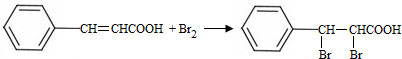 ;試劑a 是NaOH、醇溶液.
;試劑a 是NaOH、醇溶液.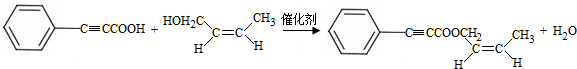 .
.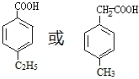 (寫出一種即可).
(寫出一種即可).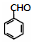 和CH3CHO為原料合成
和CH3CHO為原料合成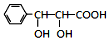 的合成路線流程圖:
的合成路線流程圖: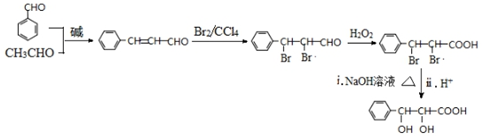 .(其它試劑任選,合成路線常用的表示方式為:CH3CH2OH$→_{170℃}^{濃H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
.(其它試劑任選,合成路線常用的表示方式為:CH3CH2OH$→_{170℃}^{濃H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$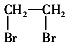 )
)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
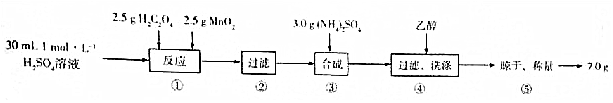
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應的化學能可以轉化為電能 | |
| B. | 該反應的△H值與反應方程式的化學計量數有關 | |
| C. | 該反應的反應物的總能量高于生成物的總能量 | |
| D. | 該反應中反應物的化學鍵斷裂放出能量,生成物化學鍵形成吸收能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中肯定不存在的離子只有Cu2+ | B. | Fe3+和Cu2+均完全被鐵粉還原 | ||
| C. | 濾液中滴加KSCN溶液顯紅色 | D. | 濾渣中肯定不含有銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
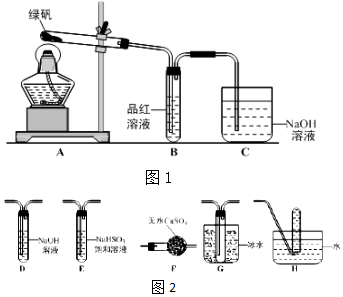
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com