
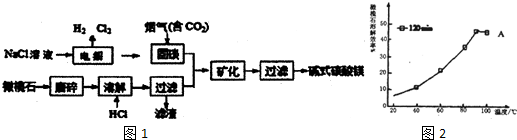
分析 由流程可知,氯化鈉溶液電解得到氯氣、氫氣和氫氧化鈉溶液,利用氫氧化鈉溶液固碳,生成碳酸鹽,橄欖石的主要成分為Mg2SiO4,磨碎加入鹽酸溶解過濾得到濾液和碳酸鹽混合礦化得到堿式碳酸鎂,
(1)根據能和二氧化碳之間反應的物質能來固定二氧化碳來回答;
(2)依據影響反應速率因素分析判斷,升溫、增大濃度,增大接觸面積會提高反應速率;溫度對化學反應平衡移動的影響知識分析90%橄欖石溶解效率開始降低的原因;
(3)A是否洗凈是利用實驗檢驗最后一次洗滌液中是否含有氯離子,氯離子的檢驗用硝酸酸化的硝酸;
(4)理論上此工廠1小時排放煙氣22.4m3/min×60min,其中二氧化碳體積=22.4m3/min×60min×15%,據此計算二氧化碳物質的量,結合碳元素守恒計算堿式碳酸鎂的質量.
解答 解:(1)固碳時發生的主要反應的化學方程式為氫氧化鈉和二氧化碳反應生成碳酸氫鈉或生成碳酸鈉,反應的化學方程式為:NaOH+CO2=NaHCO3或寫為2NaOH+CO2=Na2CO3+H2O,所給的物質中,Na2CO3和NH3•H2O可以和二氧化碳之間反應,能用作“固碳”的試劑,
故答案為:NaOH+CO2=NaHCO3或2NaOH+CO2=Na2CO3+H2O;ac;
(2)為提高HC1溶液溶解橄欖石的效率,可采取的措施適當提高溫度,適當增大HCl溶液的濃度或攪拌或增大接觸面積等,程中將橄欖石磨碎后再進行溶解的目的是增大接觸面積,加快溶解速率,圖2中所示數據以及曲線變化知道,20min后,溶解達到平衡,而該反應是放熱,升溫,平衡逆向移動,則溶解效率降低,
故答案為:增大接觸面積,加快溶解速率;90℃、120min時,溶解達到平衡,而反應放熱,升溫平衡逆向移動,故溶解效率降低;
(3)判斷產品洗凈只需要檢驗洗滌液中不含有氯離子即可,氯離子的檢驗用硝酸酸化的硝酸銀,操作是:取少量最后一次的洗滌液,加硝酸酸化的硝酸銀溶液,如無沉淀產生,則已洗凈,
故答案為:取少量最后一次的洗滌液,加硝酸酸化的硝酸銀溶液,若無沉淀產生,則已洗凈;
(4)理論上此工廠1小時排放煙氣22.4m3/min×60min,其中二氧化碳體積=22.4m3/min×60min×15%,二氧化碳物質的量等于堿式碳酸鎂的物質的量=$\frac{22.4{m}^{3}/min×60min×15%×1000L/{m}^{3}}{22.4L/mol}$,堿式碳酸鎂的質量=$\frac{22.4{m}^{3}/min×60min×15%×1000L/{m}^{3}}{22.4L/mol}$×142g/mol=1278000g=1278kg,
故答案為:1278.
點評 本題考查了物質分離提純的分析判斷,主要是試劑選擇和過程分析判斷,離子檢驗方法,元素守恒的計算應用,掌握基礎是關鍵,題目難度中等.


 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源: 題型:解答題
 ,該元素的名稱是氧;
,該元素的名稱是氧;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖為實驗室某濃鹽酸試劑瓶的標簽,試根據標簽上的有關數據回答下列問題:
如圖為實驗室某濃鹽酸試劑瓶的標簽,試根據標簽上的有關數據回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,2.8 g乙烯和丙烯的混合氣體中所含碳原子數為0.2NA | |
| B. | 0.5 mol苯分子中含有C=C雙鍵數為1.5 NA | |
| C. | 1 mol甲基(-CH3)所含的電子總數為10 NA | |
| D. | 標準狀況下,1L甲醇完全燃燒后生成的CO2分子數目約為$\frac{{N}_{A}}{22.4}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,結構簡式H2C=CH2.
,結構簡式H2C=CH2.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 離 子 | 要 求 |
| A | NH4+、Al3+、SO42-、H+ | 滴加NaOH溶液立刻有氣體產生 |
| B | K+、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| C | Fe2+、NO3-、SO42-、Cl- | 逐滴滴加鹽酸時溶液沒有顏色變化 |
| D | Na+、HCO3-、Mg2+、SO42- | 滴加氨水立即有沉淀產生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com