
 4Na2SO4•2H2O2•NaCl又稱固體雙氧水,具有漂白、殺菌、消毒作用,又由于其穩定性比過碳酸鈉(2Na2CO3•3H2O2)固體更好,因而具有廣泛的應用前景.某小組合成該固體雙氧水的實驗步驟和裝置示意圖如下:
4Na2SO4•2H2O2•NaCl又稱固體雙氧水,具有漂白、殺菌、消毒作用,又由于其穩定性比過碳酸鈉(2Na2CO3•3H2O2)固體更好,因而具有廣泛的應用前景.某小組合成該固體雙氧水的實驗步驟和裝置示意圖如下:數據 時間 | 樣品取用數量(g) | 平均V(KMnO4)/mL |
| 放置前測定 | a | 25.00 |
| 放置一個月后測定 | a | 24.90 |

分析 (1)根據控制反應溫度15~35℃可知,裝置中必須要有溫度計,根據題中提供的物質,利用元素守恒可寫化學方程式;
(2)控制反應放出的熱量可以通過控制反應物的量,也可以通過攪拌、冰水浴等方式促使熱量散失等措施;
(3)因為雙氧水不穩定,所以合成反應過程中30%的H2O2溶液適當過量,但不能太多,雙氧水太多,4Na2SO4•2H2O2•NaCl在其中的溶解的量就多,產品的產率低;
(4)2Na2CO3•3H2O2中碳酸鈉水解呈堿性,而雙氧水在堿性條件容易分解;
(5)根據高錳酸鉀溶液本身的顏色的變化判斷滴定的終點,根據滴定操作的規范要求選擇;
(6)根據產品用去的高錳酸鉀溶液的體積可計算出產品中雙氧水的質量分數,利用產品穩定性=(放置一個月后雙氧水的質量分數/放置前雙氧水的質量分數)×100%計算.
解答 解:(1)根據控制反應溫度15~35℃可知,裝置中必須要有溫度計,所以方框中應添加儀器a為溫度計,合成4Na2SO4•2H2O2•NaCl的化學方程式為4Na2SO4+2H2O2+NaCl=4Na2SO4•2H2O2•NaCl,
故答案為:溫度計;4Na2SO4+2H2O2+NaCl=4Na2SO4•2H2O2•NaCl;
(2)控制溫度可以控制反應放出的熱量可以通過控制反應物的量,也可以通過攪拌、冰水浴等方式促使熱量散失等措施達到控制溫度的目的,
故選:ACD;
(3)因為雙氧水不穩定,所以合成反應過程中30%的H2O2溶液適當過量,但不能太多,雙氧水太多,4Na2SO4•2H2O2•NaCl在其中的溶解的量就多,產品的產率低,所以30%的H2O2溶液不應大大過量,以減小產品的溶解損失,提高產率,
故答案為:減小產品的溶解損失,提高產率;
(4)2Na2CO3•3H2O2中碳酸鈉水解呈堿性,而雙氧水在堿性條件容易分解,所以4Na2SO4•2H2O2•NaCl固體比過碳酸鈉(2Na2CO3•3H2O2)固體更穩定,
故答案為:2Na2CO3•3H2O2中碳酸鈉水解呈堿性,而雙氧水在堿性條件容易分解;
(5)高錳酸鉀溶液裝于滴定管中,當滴定到達終點時的現象是溶液從無色剛好變為淺紅色,且保持30s不褪色,右滴定過程中涂凡士林可以防止活塞少漏液體,故A正確;排氣泡時速度不能太快,要慢慢擠出氣泡,故B錯誤;測定時一手握住活塞,另一手拿住錐形瓶,并不斷振蕩,故C正確,讀數是目光要平視液面,故D錯誤,故選AC,
故答案為:溶液從無色剛好變為淺紅色,且保持30s不褪色;AC;
(6)根據產品用去的高錳酸鉀溶液的體積可計算出產品中雙氧水的質量分數,兩次用的是同一份樣品,所以有高錳酸鉀溶液的體積之比=雙氧水的質量分數之比,所以產品穩定性=(放置一個月后雙氧水的質量分數/放置前雙氧水的質量分數)×100%=$\frac{24.9}{25}$×100%=99.6%,
故答案為:99.6%.
點評 本題考查了4Na2SO4•2H2O2•NaCl的制備及性質實驗方案設計,側重于制備實驗操作、物質的分離提純、離子方程式的書寫、數據的處理和計算、滴定原理的應用等知識點的考查,清楚制備的原理是解答的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
 在體積為2L的恒容密閉容器中發生反應xA(g)+yB(g)?zC(g),圖甲表示200℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A):n(B)的變化關系.則下列結論正確的是
在體積為2L的恒容密閉容器中發生反應xA(g)+yB(g)?zC(g),圖甲表示200℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A):n(B)的變化關系.則下列結論正確的是| A. | 200℃時,反應從開始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 由圖乙可知,反應xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在2 L恒容絕熱(與外界沒有熱量交換)密閉容器進行該反應,化學平衡常數減小.達到平衡時,A的體積分數小于0.5 | |
| D. | 200℃時,起始向容器中充入0.2 mol A、0.4 mol B和0.4 mol C,反應達到平衡前的速率:v(正)<v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/min | c(N2)/mol•L-1 | c(H2)/mol•L-1 | c(NH3)/mol•L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在標準狀況下,560 mL甲烷與甲醛組成的混合物中含有的共用電子對數為0.1 NA | |
| B. | 電解精煉銅時轉移了6.02×1023個電子,陽極溶解32 g銅 | |
| C. | 2.24 LCO和2.8gN2組成的混合物中質子數為2.8 NA | |
| D. | 含0.2 mol H2SO4的濃硫酸與足量銅反應,生成SO2的分子數為0.1×6.02×1023 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O2和NaOH | B. | CH3COONa和NaOH | C. | CCl4和H2O | D. | CO2和H2O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 →
→
 ,其核磁共振氫譜有2種峰.
,其核磁共振氫譜有2種峰. ,
,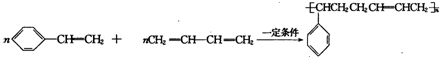 .
. (其中一種).
(其中一種).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al2O3是氧化劑 | B. | N2被氧化 | ||
| C. | AlN的摩爾質量為41 g | D. | 生成1 mol AlN轉移3 mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,16gO2含有的核外電子數為8 NA | |
| B. | 一定條件下,0.1mol鐵與0.1mol Cl2充分反應,轉移的電子數約為0.3 NA | |
| C. | 標準狀況下,22.4L氨水含有NA個NH3分子 | |
| D. | 28gC2H4中含有C-H鍵的數目為3 NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com