
【題目】水合肼(N2H4·H2O)可用作抗氧劑等,工業上常用尿素[CO(NH2)2]和 NaClO溶液反應制備水合肼。
已知:Ⅰ.N2H4·H2O 的結構如圖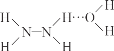 (…表示氫鍵)。
(…表示氫鍵)。
Ⅱ.N2H4·H2O 沸點 118 ℃,具有強還原性。
(1)將 Cl2 通入過量 NaOH 溶液中制備 NaClO,得到溶液 X,離子方程式是__。
(2)制備水合肼:將溶液 X 滴入尿素水溶液中,控制一定溫度,裝置如圖 a(夾持及控溫裝置已略)。充分反應后,A 中的溶液經蒸餾獲得水合肼粗品后,剩余溶液再進一步處理還可獲得副產品 NaCl 和Na2CO3·10H2O。

①A 中反應的化學方程式是__。
②冷凝管的作用是__。
③若滴加 NaClO 溶液的速度較快時,水合肼的產率會下降,原因是__。
④NaCl 和 Na2CO3 的溶解度曲線如圖 b。由蒸餾后的剩余溶液獲得 NaCl 粗品的操作是__。
(3)水合肼在溶液中可發生類似 NH3·H2O 的電離,呈弱堿性;其分子中與 N 原子相連的 H 原子易發生取代反應。
①水合肼和鹽酸按物質的量之比 1∶1 反應的離子方程式是__。
②碳酰肼(CH6N4O)是目前去除鍋爐水中氧氣的最先進材料,由水合肼與 DEC( ![]() )發生取代反應制得。碳酰肼的結構簡式是__。
)發生取代反應制得。碳酰肼的結構簡式是__。
【答案】Cl2 +2OH-=Cl-+ ClO-+H2O NaClO+CO(NH2)2+2NaOH ![]() N2H4·H2O+ NaCl+Na2CO3 冷凝回流水合肼 N2H4·H2O被NaClO氧化 加熱至有大量固體析出,趁熱過濾 N2H4·H2O+ H+=N2H5++H2O
N2H4·H2O+ NaCl+Na2CO3 冷凝回流水合肼 N2H4·H2O被NaClO氧化 加熱至有大量固體析出,趁熱過濾 N2H4·H2O+ H+=N2H5++H2O ![]()
【解析】
(1)Cl2與過量 NaOH溶液反應生成NaClO、NaCl和H2O,則得到溶液X的離子方程式為Cl2 +2OH-=Cl-+ ClO-+H2O;
(2)①A 中的反應為堿性條件下,次氯酸鈉與尿素發生氧化還原反應生成水合肼、碳酸鈉和氯化鈉,反應的化學方程式NaClO+CO(NH2)2+2NaOH ![]() N2H4·H2O+ NaCl+Na2CO3;
N2H4·H2O+ NaCl+Na2CO3;
②由題意可知水合肼的沸點低,易揮發,為防止水合肼揮發,造成產率降低,應選用冷凝管冷凝回流,故答案為:冷凝回流水合肼;
③水合肼有強還原性,NaClO具有強氧化性,若滴加 NaClO 溶液的速度較快時,反應生成的水合肼會被次氯酸鈉氧化,導致產率會下降,故答案為:N2H4·H2O被NaClO氧化;
④由溶解度曲線可知,碳酸鈉的溶解度隨溫度變化大,氯化鈉溶解度隨溫度變化小,則獲得 NaCl 粗品的操作是加熱至有大量固體析出,趁熱過濾,防止降溫時碳酸鈉析出,故答案為:加熱至有大量固體析出,趁熱過濾;
(3)①水合肼和鹽酸按物質的量之比 1∶1反應生成N2H5Cl和水,反應的離子方程式N2H4·H2O+ H+=N2H5++H2O;
②一定條件下,水合肼與![]() 發生取代反應生成
發生取代反應生成![]() 和乙醇,則碳酰肼的結構簡式是
和乙醇,則碳酰肼的結構簡式是![]() ,故答案為:
,故答案為:![]() 。
。


 同步學典一課多練系列答案
同步學典一課多練系列答案 經典密卷系列答案
經典密卷系列答案 金牌課堂練系列答案
金牌課堂練系列答案 三新快車金牌周周練系列答案
三新快車金牌周周練系列答案科目:高中化學 來源: 題型:
【題目】學生為探究苯與溴發生反應的原理,用如圖所示裝置進行了實驗。根據相關知識回答下列問題:

(1)實驗開始時,關閉K2,開啟K1和分液漏斗活塞,滴加苯和液溴的混合液,反應開始。過一會兒,在裝置Ⅲ中可能觀察到的現象是______________________________________。
(2)整套實驗裝置中能防止倒吸的裝置有___________________________(填裝置序號)。
(3)寫出裝置Ⅱ中發生反應的化學方程式:_____________________________________。
(4)本實驗能不能用溴水代替液溴?___________________________________________。
(5)采用冷凝裝置,其作用是_________________________________________________。
(6)Ⅲ裝置中小試管內苯的作用是_____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氯化硼(BCl3)是一種重要的化工原料。實驗室制備BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某實驗小組利用干燥的氯氣和下列裝置(裝置可重復使用)制備BCl3并驗證反應中有CO生成。已知:BCl3的熔點為-107.3℃,沸點為12.5℃,遇水水解生成H3BO3和HCl,請回答下列問題:
(實驗Ⅰ)制備BCl3并驗證產物CO

(1)該實驗裝置中合理的連接順序為G→_____→_____→_____→____→F→D→I。其中裝置E的作用是___________________________。
(2)裝置J中反應的化學方程式為____________________________________。
(實驗Ⅱ)產品中氯含量的測定
①準確稱取少許m克產品,置于蒸餾水中完全水解,并配成100mL溶液。
②取10.00mL溶液于錐形瓶中
③加入V1mL濃度為C1 mol/LAgNO3溶液使氯離子完全沉淀;向其中加入少許硝基苯用力搖動。
④以硝酸鐵為指示劑,用C2 mol/L KSCN標準溶液滴定過量的AgNO3溶液。發生反應:Ag+ +SCN- =AgSCN↓。
⑤重復步驟②~④二次,達到滴定終點時用去KSCN溶液的平均體積為V2 mL。
已知: Ksp(AgCl)>Ksp(AgSCN) 。
(3)步驟④中達到滴定終點的現象為__________________。
(4)實驗過程中加入硝基苯的目的是___________________。
(5)產品中氯元素的質量分數為_________________%。
(6)下列操作,可能引起測得產品中氯含量偏高是__________。
A.步驟③中未加硝基苯
B.步驟①中配制100mL溶液時,定容時俯視刻度線
C.用KSCN溶液滴定剩余AgNO3溶液時,滴定前有氣泡,滴定后無氣泡
D.滴定剩余AgNO3溶液時,KSCN溶液滴到錐形瓶外面一滴
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫時,向 20 mL 0.1 mol·L 1 的兩種酸 HA、HB 中分別滴加 0.1 mol·L 1NaOH 溶液, 其 pH 變化分別對應下圖中的Ⅰ、Ⅱ。下列說法不正確的是

A.向 NaA 溶液中滴加 HB 可產生 HA
B.a點,溶液中微粒濃度:c(A-) > c(Na+) > c(HA)
C.滴加 NaOH 溶液至 pH=7 時,兩種溶液中 c(A-)= c(B-)
D.滴加 20 mL NaOH 溶液時,Ⅰ中 H2O 的電離程度大于Ⅱ中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某草藥中有一種色素,它的結沒食子兒茶素的結構簡式如圖,它是目前尚不能人工合成的純天然、高效能的抗氧化劑.下列關于該物質的敘述正確的是( )
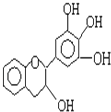
A.分子式為C15H12O5
B.1 mol 該物質與4mol NaOH恰好完全反應
C.該物質在濃硫酸作用下可發生消去反應
D.該物質可以和溴水發生取代反應和加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:R-CH=CH-O-R′(烴基烯基醚)![]() R-CH2CHO + R′OH
R-CH2CHO + R′OH
烴基烯基醚A的相對分子質量(Mr)為176,分子中碳氫原子數目比為3∶4 。與A相關的反應如下:
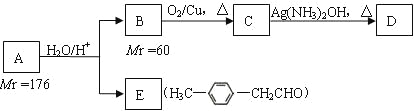
根據題意完成下面小題:
(1)A的分子式為_________________;
(2)B的名稱是___________________;A的結構簡式為_______________________;
(3)寫出C → D反應的化學方程式:__________________________;
(4)寫出兩種同時符合下列條件的E的同分異構體的結構簡式:__________、__________。
① 屬于芳香醛;② 苯環上有兩種不同環境的氫原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇不僅是重要的化工原料,而且還是性能優良的能源和車用燃料。
Ⅰ.甲醇水蒸氣重整制氫是電動汽車氫氧燃料電池理想的氫源,生產過程中同時也產生CO,CO會損壞燃料電池的交換膜。相關反應如下:
反應①CH3OH(g) + H2O(g)CO2(g) + 3H2(g) △H1
反應②H2(g)+CO2(g)CO(g) + H2O(g) △H2=+41kJ/mol
如圖表示恒壓容器中0.5mol CH3OH(g)和0.5mol H2O(g)轉化率達80%時的能量變化。
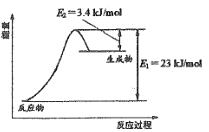
(1)計算反應①的△H1= ________。
(2)反應①能夠自發進行的原因是________。升溫有利于提高CH3OH轉化率,但也存在一個明顯的缺點是 _________。
(3)恒溫恒容下,向密閉容器中通入體積比為1:1的H2和CO2,能判斷反應CH3OH(g) + H2O(g)CO2(g) + 3H2(g)處于平衡狀態的是____________。
A.體系內壓強保持不變
B.體系內氣體密度保持不變
C.CO2的體積分數保持不變
D.斷裂3mol H-H鍵的同時斷裂3mol H-O鍵
(4)250℃,一定壓強和催化劑條件下,1.00mol CH3OH 和 1.32mol H2O充分反應,平衡測得H2為2.70mol,CO為 0.030mol,則反應①中CH3OH的轉化率_________,反應②的平衡常數是 _________(以上結果均保留兩位有效數字)。
Ⅱ.如圖是甲醇燃料電池工作示意圖:
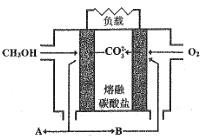
(5)當內電路轉移1.5molCO32-時,消耗甲醇的質量是_________g。
(6)正極的電極反應式為 _______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2O2分解速率受多種因素影響。實驗測得 70 ℃時不同條件下H2O2濃度隨時間的變化如圖所示。下列說法正確的是
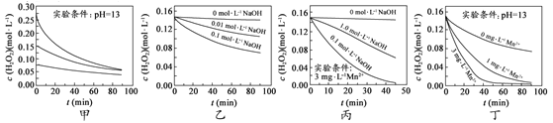
A.圖甲表明,其他條件相同時,H2O2濃度越小,其分解速率越快
B.圖乙表明,其他條件相同時,溶液pH越小,H2O2分解速率越快
C.圖丙表明,少量Mn 2+存在時,溶液堿性越強,H2O2分解速率越快
D.圖丙和圖丁表明,堿性溶液中,Mn2+對H2O2分解速率的影響大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式硫酸鐵[Fe(OH)SO4]是重要的化工原料,工業上利用廢鐵屑(含少量氧化鋁、 氧化鐵等)生產堿式硫酸鐵的工藝流程如下:
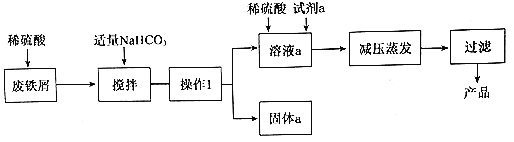
已知:Ksp[Fe(OH)3]=2.6×10-39 Ksp[Fe(OH)2]=4.9×10-17 Ksp[Al(OH)3]=8×10-32(單位略)
(1)工業生產中,常將廢鐵塊處理為廢鐵屑,其目的是_______;用稀硫酸處理廢鐵屑的過程中______個氧化還原反應發生。
(2)加入碳酸氫鈉后,發生反應的主要離子方程式為_______。
(3)若要使沉淀完全(一般認為離子濃度小于10-5 molL-1即為沉淀完全),溶液的pH為________;此溶液中亞鐵離子的物質的量濃度不高于_____molL-1才不會生成沉淀。
(4)從環保、產品純度角度分析.試劑a最好選擇下列物質中的_____(填字母代號)。
A NaClO B KNO3 C H2O2 D KMnO4
(5)若攪拌過程中NaHCO3過量,會產生FeCO3沉淀和大量氣泡,若將NaHCO3改為 Na2CO3過量時產生的沉淀為FeCO3和Fe(OH)2的混合物,試解釋混合物中有Fe(OH)2的原因___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com