
【題目】三氯化硼(BCl3)是一種重要的化工原料。實驗室制備BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某實驗小組利用干燥的氯氣和下列裝置(裝置可重復使用)制備BCl3并驗證反應中有CO生成。已知:BCl3的熔點為-107.3℃,沸點為12.5℃,遇水水解生成H3BO3和HCl,請回答下列問題:
(實驗Ⅰ)制備BCl3并驗證產物CO

(1)該實驗裝置中合理的連接順序為G→_____→_____→_____→____→F→D→I。其中裝置E的作用是___________________________。
(2)裝置J中反應的化學方程式為____________________________________。
(實驗Ⅱ)產品中氯含量的測定
①準確稱取少許m克產品,置于蒸餾水中完全水解,并配成100mL溶液。
②取10.00mL溶液于錐形瓶中
③加入V1mL濃度為C1 mol/LAgNO3溶液使氯離子完全沉淀;向其中加入少許硝基苯用力搖動。
④以硝酸鐵為指示劑,用C2 mol/L KSCN標準溶液滴定過量的AgNO3溶液。發生反應:Ag+ +SCN- =AgSCN↓。
⑤重復步驟②~④二次,達到滴定終點時用去KSCN溶液的平均體積為V2 mL。
已知: Ksp(AgCl)>Ksp(AgSCN) 。
(3)步驟④中達到滴定終點的現象為__________________。
(4)實驗過程中加入硝基苯的目的是___________________。
(5)產品中氯元素的質量分數為_________________%。
(6)下列操作,可能引起測得產品中氯含量偏高是__________。
A.步驟③中未加硝基苯
B.步驟①中配制100mL溶液時,定容時俯視刻度線
C.用KSCN溶液滴定剩余AgNO3溶液時,滴定前有氣泡,滴定后無氣泡
D.滴定剩余AgNO3溶液時,KSCN溶液滴到錐形瓶外面一滴
【答案】E H J H 將BCl3冷凝為液態分離出來 2NaOH+Cl2 =NaCl+NaClO+H2O 覆蓋AgCl,滴入最后一滴KSCN溶液時,混合液由無色變為血紅色且半分鐘內不褪色 防止滴定時AgCl沉淀轉化為AgSCN沉淀,使滴定終點不準確 ![]() B
B
【解析】
Ⅰ.用氯氣與B2O3、C反應生成三氯化硼和CO,三氯化硼的熔點為-107.3℃,沸點為12.5℃,所以收集三氯化硼要用冰水冷卻,未反應的氯氣尾氣用氫氧化鈉吸收,三氯化硼易水解,為防止氫氧化鈉溶液中水進入裝置E,在E和J之間接上H裝置,用于吸水,生成的CO干燥后再通過F裝置還原氧化銅,再將生成的氣體通過澄清石灰水檢驗,可以證明原反應中有一氧化碳生成,多余的CO不能排放到空氣中,要用排水法收集,據此答題。
II.(3)根據Fe3+、SCN-反應產生血紅色物質判斷滴定終點;
(4)硝基苯是液態有機物,密度比水大,可以覆蓋在AgCl上,防止AgCl發生沉淀溶解;
(5)根據n(Ag+)=n(Cl-)+n(SCN-),可計算出溶液中10.00mL溶液中含有的n(Cl-),然后計算mg即100mL中含有的n(Cl-)及質量,從而計算出其質量分數;根據c=![]() 進行誤差分析。
進行誤差分析。
I.(1)用氯氣與B2O3、C反應生成三氯化硼和CO,三氯化硼的熔點為-107.3℃,沸點為12.5℃,所以收集三氯化硼要用冰水冷卻,未反應的氯氣尾氣用氫氧化鈉吸收,三氯化硼易水解,為防止氫氧化鈉溶液中水進入裝置E,在E和J之間接上H裝置,用于吸水,生成的CO經干燥后再通過F裝置還原氧化銅,再將生成的氣體通過澄清石灰水檢驗,可以證明原反應中有一氧化碳生成,多余的CO不能排放到空氣中,要用排水法收集,據上面的分析可知,依次連接的合理順序為G→E→H→J→H→F→D→I,故答案為:E、H、J、H;反應產生的BCl3為氣態,用冰水冷卻降溫變為液態,便于與未反應的氯氣分離開來,所以其中裝置E的作用是將BCl3冷凝為液態分離出來;
(2)中裝置J中Cl2與NaOH溶液發生歧化反應,產生NaCl、NaClO、H2O,根據電子守恒、原子守恒,可得該反應的化學方程式為2NaOH+Cl2 =NaCl+NaClO+H2O;
II.(3)向該物質中加入AgNO3溶液,發生反應:Ag++Cl-=AgCl↓,為了使溶液中的Cl-沉淀完全,加入過量的AgNO3溶液,然后以硝酸鐵為指示劑,若溶液中Cl-沉淀完全,用C2 mol/L KSCN標準溶液滴定過量的AgNO3溶液。會發生反應:Ag+ +SCN- =AgSCN↓,溶液變為血紅色,所以滴定終點現象為滴入最后一滴KSCN溶液時,混合液由無色變為血紅色且半分鐘內不褪色;
(4)硝基苯是液態有機物,密度比水大,加入硝基苯就可以覆蓋在反應產生AgCl沉淀上,防止滴定時AgCl沉淀轉化為AgSCN沉淀,使滴定終點不準確;
(5)根據離子反應可知n(Ag+)=n(Cl-)+n(SCN-),則10.00mL中含有n(Cl-)=n(Ag+)-n(SCN-)=C1 mol/L×V1×10-3L/mL –C2mol/L×V2 mL×10-3L/mL=(C1V1-C2V2)×10-3mol;則mg中含有Cl-元素的質量為m= (C1V1-C2V2)×10-3mol×![]() ×35.5g/mol,則產品中氯元素的質量分數為
×35.5g/mol,則產品中氯元素的質量分數為![]() =
=![]() ;
;
A.步驟③中未加硝基苯,會使一部分AgCl轉化為AgSCN,導致n(SCN-)增大,根據關系式n(Ag+)=n(Cl-)+n(SCN-)可知樣品中含有n(Cl-)偏小,A錯誤;
B.步驟①中配制100mL溶液時,定容時俯視刻度線,則使c(Cl-)偏大,等體積時含有的n(Cl-)偏大,B正確;
C.用KSCN溶液滴定剩余AgNO3溶液時,滴定前有氣泡,滴定后無氣泡,V(標)偏大,則導致樣品在Cl-含量偏低,C錯誤;
D.滴定剩余AgNO3溶液時,KSCN溶液滴到錐形瓶外面一滴,V(標)偏大,則導致樣品在Cl-含量偏低,D錯誤;
故合理選項是B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】到目前為止,由化學能轉變的熱能或電能仍然是人類使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃燒生成CO2和液態水時放出352kJ的熱量,則表示甲醇燃燒熱的熱化學方程式___。
(2)化學反應中放出的熱能(焓變,△H)與反應物和生成物的鍵能(E)有關。
已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol, E(Cl﹣Cl)=243kJ/mol則E(H﹣Cl)=___。
(3)①如圖是N2和H2反應生成2molNH3過程中能量變化示意圖,請計算每生成1molNH3放出熱量為:___;
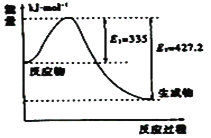
②若起始時向容器內放入1molN2和3molH2,達平衡后N2的轉化率為20%,則反應放出的熱量為Q1kJ,則Q1的數值為___;
(4)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=akJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) ΔH=bkJ·mol-1;
O2(g)=CO2(g) ΔH=bkJ·mol-1;
C(石墨)+O2(g)=CO2(g) ΔH=ckJ·mol-1
則反應:4Fe(s)+3O2(g)=2Fe2O3(s)的焓變ΔH=___kJ·mol-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵及其化合物在T農業生產中有重要的作用
(1)![]() 在空氣屮灼燒可制得鐵系氧化物材料。已知
在空氣屮灼燒可制得鐵系氧化物材料。已知![]() ,101kPa時:
,101kPa時:
![]()
![]()
![]()
![]()
寫出![]() 在空氣中灼燒生成
在空氣中灼燒生成![]() 的熱化學方程式______
的熱化學方程式______
(2)生產中常用CO還原鐵的氧化物冶煉鐵。T業上可利用甲烷與水蒸氣反應制備CO原料氣:![]() 。如圖是
。如圖是![]() 與
與![]() 初始體積比為1:3時乎衡體系中甲烷的體積分數受溫度、壓強影響的關系圖:
初始體積比為1:3時乎衡體系中甲烷的體積分數受溫度、壓強影響的關系圖:
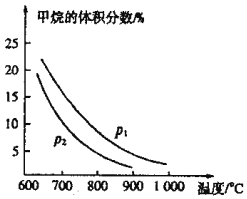
①甲烷與水蒸氣反應制備CO的反應為______![]() 填“放熱”或“吸熱”
填“放熱”或“吸熱”![]() 反應,壓強
反應,壓強![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]()
②在恒溫恒壓的條件下,上述反應達到平衡狀態。當改變反應的某一個條件后,下列變化能說明平衡一定向逆反應方向移動的是______
A.逆反應速率先增大后減小
B.混合氣體的密度減小
C.化學平衡常數K值減小
D.水蒸氣的轉化率減小
③在恒溫、恒容的條件下,向上述平衡體系中充人體積比為:3的甲烷與水蒸氣混合氣體,再次達到平衡時CO的體積分數______![]() 填“增大”、減小”或“不變”
填“增大”、減小”或“不變”![]() ,
,
(3)已知![]() 時,
時,![]() ,該溫度下反應
,該溫度下反應![]() 的平衡常數
的平衡常數![]() ______
______
(4)工業上通過電解濃NaOH溶液可制備![]() ,然后轉化為
,然后轉化為![]() ,電解原理如圖所示,則A溶液中溶質的成分為______
,電解原理如圖所示,則A溶液中溶質的成分為______![]() 填化學式
填化學式![]() :陽極的電極反應式為______
:陽極的電極反應式為______
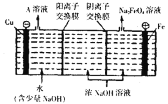 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為探究外界條件對反應:mA(g)+nB(g)![]() cZ(g)ΔH的影響,以A和B的物質的量之比為m:n開始反應,通過實驗得到不同條件下反應達到平衡時Z的物質的量分數,實驗結果如圖所示。下列判斷正確的是( )
cZ(g)ΔH的影響,以A和B的物質的量之比為m:n開始反應,通過實驗得到不同條件下反應達到平衡時Z的物質的量分數,實驗結果如圖所示。下列判斷正確的是( )
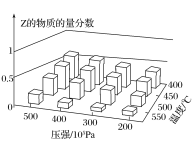
A.ΔH>0
B.m+n<c
C.升高溫度,正、逆反應速率都增大,平衡常數減小
D.恒溫恒壓時,向已達平衡的體系中加入少量Z(g),再次達到平衡后Z的物質的量分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了檢驗在氫氣和二氧化碳的混合氣體中是否混入了一氧化碳,用如下的裝置進行實驗。請回答:
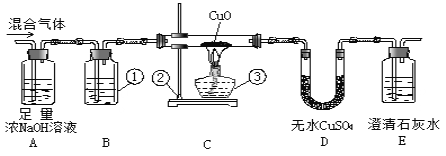
(1)寫出標有番號的儀器名稱:①___________,②_____________,③_____________。
(2)裝置B中用的試劑是 _______________,目的是為了_______________________。
(3)當觀察到E裝置中出現____________現象時,說明混合氣體中一定含有一氧化碳。
(4)如果混合氣體中含有一氧化碳,為了保護環境,應在E裝置右邊的排氣管口采取的措施是_____。
(5)A裝置的作用是___________,反應的化學方程式是___________________。
(6)假設混合氣體中的CO與CuO完全反應,當通入的氣體為mg, D增重ng,E瓶增重pg。則混合氣體中CO的質量百分數為:_________%;如果去掉D裝置,這里計算的CO的質量百分數準確嗎?為什么?___________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水溶液中存在多種平衡,請根據所學化學知識回答下列問題:
(1)在濃度均為0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+濃度由大到小的順序為(填序號)___。
(2)濃度均為0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氫氧化鈉、④氯化銨四種溶液中的H+濃度由大到小的順序是(填序號)___。
(3)恒溫下,向pH=6的蒸餾水中加入2.3g金屬鈉,充分反應后,再加蒸餾水稀釋到1L,所得溶液的pH=___。
(4)將FeCl3、NaHCO3、K2SO3溶液蒸干、灼燒后得到的固體物質分別是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗操作和現象能得出相應結論的是( )
選項 | 實驗操作 | 現象 | 結論 |
A | SO2緩慢通入滴有酚酞的NaOH溶液中 | 溶液紅色褪去 | SO2具有漂白性 |
B | 將充滿NO2的密閉玻璃球浸泡在熱水中 | 氣體紅棕色加深 | 2NO2(g) |
C | 某黃色溶液X中加入淀粉-KI溶液 | 溶液變成藍色 | 溶液X中含有Br2 |
D | 無水乙醇中加入濃硫酸,加熱,產生的氣體Y通入酸性KMnO4溶液 | 溶液紫色褪去 | 氣體Y中含有乙烯 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某蓄電池放電、充電時的反應為:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推斷中正確的是( )
Fe(OH)2+2Ni(OH)2 下列推斷中正確的是( )
放電時,Fe為正極,Ni2O3為負極
②充電時,陰極上的電極反應式是:Fe(OH)2+2e-===Fe+2OH-
③充電時,Ni(OH)2為陽極
④該蓄電池的電極必須是浸在某種堿性電解質溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】廢氣中的H2S通過高溫熱分解可制取氫氣:2H2S(g)![]() 2H2(g)+S2(g)。現在3L密閉容器中,控制不同溫度進行H2S分解實驗。
2H2(g)+S2(g)。現在3L密閉容器中,控制不同溫度進行H2S分解實驗。
(1)某溫度時,測得反應體系中有氣體1.3lmol,反應1 min后,測得氣體為l.37mol,則tmin 內H2的生成速率為___________。
(2)某溫度時,H2S的轉化率達到最大值的依據是_____________(選填編號)。
a.氣體的壓強不發生變化 b.氣體的密度不發生變化
c.![]() 不發生變化 d.單位時間里分解的H2S和生成的H2一樣多
不發生變化 d.單位時間里分解的H2S和生成的H2一樣多
(3)實驗結果如下圖。圖中曲線a表示H2S的平衡轉化率與溫度關系,曲線b表示不同溫度下、反應經過相同時間且未達到化學平衡時H2S的轉化率。該反應為_____反應(填“放熱”或“吸熱”)。曲線b隨溫度的升高,向曲線a通近的原因是_________。在容器體積不變的情況下,如果要提高H2的體積分數,可采取的一種措施是________。

(4)使1LH2S與20L空氣(空氣中O2體積分數為0.2)完全反應后恢復到室溫,混合氣體的體積是______L 。若2gH2S完全燃燒后生成二氧化硫和水蒸氣,同時放出29.4 kJ的熱量,該反應的熱化學方程式是__________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com