
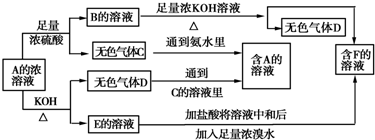
 向100mL NaOH溶液中逐漸通入一定量的CO2(假設溶液體積不變),測得最后溶液的pH>7.
向100mL NaOH溶液中逐漸通入一定量的CO2(假設溶液體積不變),測得最后溶液的pH>7.分析 (1)CO2與NaOH反應可生成Na2CO3或NaHCO3或二者混合物,NaOH剩余時,只生成Na2CO3,Na2CO3或NaHCO3溶液都呈堿性;
(2)①BC段發生:NaHCO3+HCl═NaCl+H2O+CO2↑,而OA段消耗的鹽酸為A→B消耗的鹽酸的二倍,故為NaOH和Na2CO3的混合物,OA段所發生反應:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl;
②由方程式可知,Na2CO3碳酸鈉轉化為NaHCO3消耗鹽酸體積與NaHCO3完全反應生成CO2消耗鹽酸體積相等,可以計算NaOH消耗鹽酸體積,氫氧化鈉與碳酸鈉的物質的量之比等于消耗鹽酸體積之比;
③根據n=cV計算AB段消耗HCl物質的量,根據方程式計算生成二氧化碳物質的量,再根據V=nVm計算體積;
④B點溶質為NaCl,根據鈉離子、氯離子守恒有:n(HCl)=n(NaCl)=n(NaOH),再根據c=$\frac{n}{V}$計算原NaOH溶液的物質的量濃度.
解答 解:(1)CO2與NaOH反應可生成Na2CO3或NaHCO3,二者溶液都呈堿性,則如果是單一成分,可能是Na2CO3或NaHCO3,如果是多種成分,可能是:Na2CO3、NaHCO3或NaOH、Na2CO3,
故答案為:Na2CO3或NaHCO3;Na2CO3、NaHCO3或NaOH、Na2CO3;
(2)①BC段發生:NaHCO3+HCl═NaCl+H2O+CO2↑,而OA段消耗的鹽酸為A→B消耗的鹽酸的二倍,故為NaOH和Na2CO3的混合物,OA段所發生反應:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl,反應的離子方程式分別為:OH-+H+═H2O、CO32-+H+═HCO3-;
故答案為:OH-+H+═H2O、CO32-+H+═HCO3-;
②由①中分析可知,溶液中溶質為NaOH、Na2CO3,
根據反應方程式:CO32-+H+═HCO3-、HCO3-+H+=CO2↑+H2O,可知Na2CO3碳酸鈉轉化為NaHCO3消耗鹽酸體積與NaHCO3完全反應生成CO2消耗鹽酸體積相等,均為25mL,故氫氧化鈉消耗的鹽酸體積也是50mL-25mL=25mL,即Na2CO3與NaOH的物質的量相等,其物質的量濃度之比為1:1,
故答案為:NaOH、Na2CO3;1:1;
③AB段消耗HCl物質的量為0.1mol/L×0.025L=0.0025mol,由HCO3-+H+=CO2↑+H2O,可知生成二氧化碳為0.0025mol,其體積為22.4L/mol×0.0025mol=0.56L,
故答案為:0.56L;
④B點溶質為NaCl,根據鈉離子、氯離子守恒有:n(NaOH)=n(NaCl)=n(HCl)=0.1mol/L×0.075L=0.0075mol,原NaOH溶液的物質的量濃度為$\frac{0.0075mol}{0.01L}$=0.75mol/L,
故答案為:0.75mol/L.
點評 本題考查混合物的計算,題目難度中等,本題關鍵是根據圖象判斷溶液溶質的成分,注意計算過程中守恒思想的應用.


 小學教材全測系列答案
小學教材全測系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3COOH | B. | H2 | C. | HCOOH | D. | CO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該物質可以視為酚類 | B. | 該有機物的分子式為C19H32O | ||
| C. | 能使溴的四氯化碳溶液褪色 | D. | 該物質分子中的所有碳原子均共面 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
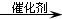
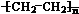 .A和水在一定條件下反應生成B,B為生活中常見的有機物,B可與另一種生活中常見有機物在一定條件下反應生成有香味的物質C,寫出生成C的化學方程式
.A和水在一定條件下反應生成B,B為生活中常見的有機物,B可與另一種生活中常見有機物在一定條件下反應生成有香味的物質C,寫出生成C的化學方程式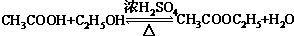 .比賽中,當運動員肌肉挫傷或扭傷時,隨隊醫生即對準受傷部位噴射氯乙烷(沸點12.27℃)進行局部冷凍麻醉應急處理.乙烯和氯化氫在一定條件下制得氯乙烷的化學反應方程式是(有機物用結構簡式表示)CH2=CH2+HC1
.比賽中,當運動員肌肉挫傷或扭傷時,隨隊醫生即對準受傷部位噴射氯乙烷(沸點12.27℃)進行局部冷凍麻醉應急處理.乙烯和氯化氫在一定條件下制得氯乙烷的化學反應方程式是(有機物用結構簡式表示)CH2=CH2+HC1 CH3CH2C1,該反應類型是加成反應.
CH3CH2C1,該反應類型是加成反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鉛蓄電池屬于二次電池 | |
| B. | 氫氟酸可用于蝕刻玻璃是因為其具有強酸性 | |
| C. | 為了防止食品受潮,常在食品包裝袋中放入活性鐵粉 | |
| D. | 用于制光纜的光導纖維是新型有機高分子材料 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com