
分析 CH3COOH是弱酸部分電離,電離時電離出自由移動的氫離子和醋酸根離子;加入與弱電解質電離出相同離子的電解質抑制電離,消耗弱電解質電離出的離子,促進電離,溫度不變,醋酸的電離平衡常數不變,以此來解答.
解答 解:CH3COOH是弱酸,在溶液中部分電離,其電離方程式為:CH3COOH?CH3COO-+H+,加入少量NaOH固體,電離出的氫氧根離子與CH3COOH電離生成的H+結合,使電離平衡正向移動,CH3COOH的電離度增大,弱電解質的電離為吸熱過程,升高溫度,電離平衡常數增大,溫度不變,醋酸的電離平衡常數不變,所以該乙酸溶液電離平衡常數不變,
故答案為:CH3COOH?CH3COO-+H+;右;增大;不變.
點評 本題考查乙酸的電離,明確影響平衡移動的因素即可解答,注意加入與弱電解質電離出相同離子的電解質抑制電離,消耗弱電解質電離出的離子,電離平衡常數受溫度影響,題目難度不大.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

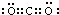 、
、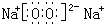 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com