
以下反應①②可用于從不同原料中提取碘:
①2NaI+MnO2+3H2SO4 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3 2Na2SO4+3NaHSO4+H2O+I2
2Na2SO4+3NaHSO4+H2O+I2
(1)反應①中的氧化劑是___________________;反應②中的還原產物是________________。
(2)根據反應①②可推知______。
a.氧化性:IO3->SO42- b.氧化性:MnO2>NaIO3
c.還原性:I->Mn2+ d.還原性:I2>NaHSO3
(3)已知NaI和NaIO3在酸性條件下能反應生成I2 ,寫出該反應的離子方程式:
③__________________________________________________________。
(4)三個反應中生成等量的I2時轉移的電子數最少的是反應________(填序號)。
(1)MnO2(二氧化錳);I2(碘)。
(2)a、c。
(3)5I-+5IO3-+6H+→3 I2+3H2O。
(4)③。
解析試題分析:(1)反應①中Mn元素化合價降低,則MnO2應為氧化劑,反應②中I元素的化合價降低,則I2為還原產物,故答案為:MnO2;I2;
(2)氧化還原反應中,氧化劑的氧化性大于氧化產物的氧化性,還原劑的還原性大于還原產物的還原性,反應①中氧化性:MnO2>I2,還原性:I->Mn2+,②中氧化性:IO3->SO42-,還原性:NaHSO3>I2,故答案為:a、c;
(3)NaI和NaIO3在酸性條件下能反應生成I2,反應的離子方程式為5I-+5IO3-+6H+=3I2+3H2O,故答案為:5I-+5IO3-+6H+=3I2+3H2O;
(4)反應①中生成1molI2轉移電子2mol,反應②中生成1molI2轉移電子10mol,反應中③生成1molI2轉移電子5/3mol,則轉移電子最小為③,故答案為:③.
考點:本題綜合考查氧化還原反應,題目側重于氧化還原反應的配平、計算以及氧化性、還原性的比較,題目難度中等.


科目:高中化學 來源: 題型:填空題
在氧化還原反應中,電子轉移的表示方法通常用單線橋法和雙線橋法。試分析這兩種表示方法的特征,并填空。
(1)標單線橋(4分)
KIO3+6HI=KI+3I2+3H2O氧化產物與還原產物物質的量之比= 。
(2)配平化學方程式及標雙線橋(5分)
Fe + HNO3(稀)= Fe(NO3)2+ NO↑+ H2O反應中,氧化劑與還原劑的物質的量之比 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)已知將鹽酸滴入高錳酸鉀溶液中,產生黃綠色氣體,而溶液的紫紅色褪去。 現有一個氧化還原反應的體系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七種物質:
①該反應中,化合價升高的反應物是________,化合價沒有發生變化的反應物是_______。
②寫出一個包含上述七種物質的氧化還原反應方程式(不需配平) ___________。
③上述反應中,氧化劑是________,1 mol氧化劑在反應中________(填“得到”或“失去”)________mol電子。
④如果在反應后的溶液中加入NaBiO3,溶液又變紫紅色。說出NaBiO3的一個性質:___________________________________________________________________。
(2)某反應體系中的物質有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①將氧化劑與還原劑填入下列空格中,并標出電子轉移的方向和數目。
反應中,被還原的元素是________,氧化產物是______________。
②紡織工業中常用氯氣作漂白劑,Na2S2O3可作為漂白布匹的“脫氯劑”,Na2S2O3和Cl2反應的產物是H2SO4、NaCl和HCl,則還原劑與氧化劑的物質的量之比為________。
(3)一定條件下,向廢水中加入CH3OH,將HNO3還原成N2。若該反應消耗3.2 g CH3OH轉移0.6 mol電子,則氧化產物為(填化學式),氧化產物與還原產物的物質的量之比是________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在 K2Cr2O7 +14HCl="2KCl" + 2CrCl3 + 3Cl2?+ 7H2O反應中。
(1) 元素被氧化, 是氧化劑。
(2) 是氧化產物, 發生氧化反應。
(3)在參加反應的鹽酸中,起還原劑(被氧化)作用的HCl與起酸性作用(未被氧化)的HCl的質量比為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)用“單線橋”表示下列反應電子轉移的方向和數目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反應中物質的氧化性:KMnO4_____ Cl2(填“>、<、=”);氧化產物與還原產物的物質的量之比為_____________。
(2)配平下列氧化還原反應方程式:___KMnO4+___H2S+__H2SO4(稀) —— __K2SO4+__MnSO4+__S↓+__H2O
(3)Cl2是一種黃綠色有毒氣體,化工廠可用濃氨水來檢驗有毒氣體Cl2是否泄漏,有關反應的化學方程式為:3Cl2+8NH3=6NH4Cl +N2若反應中NH3消耗6.8 g,則轉移電子個數為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
CuSO4溶液與K2C2O4溶液混合生成一種藍色鉀鹽水合物KaCub(C2O4)c·nH2O。通過下述實驗確定該晶體的組成。
步驟a:稱取0.6720 g樣品,放入錐形瓶,加入適量2mol·L-1稀硫酸,微熱使樣品溶解。再加入30 mL水加熱,用0.2000mol·L-1 KMnO4溶液滴定至終點,消耗8.00 mL KMnO4溶液。有關反應:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步驟b:接著將溶液充分加熱。冷卻后,調節pH并加入過量的KI固體,溶液變為棕色并產生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3標準溶液滴定至終點,消耗8.00 mL Na2S2O3溶液。滴定時反應為:I2+2S2O32-=2I-+S4O62-
(1)步驟b中生成白色沉淀的離子方程式: 。
(2)步驟b中“將溶液充分加熱”的目的是 。
(3)請完成下列確定樣品組成的計算過程。
①計算樣品中n (C2O42-)(寫出計算過程)
②計算樣品中n (Cu2+) (寫出計算過程)
③根據 原理可求出n (K+),再依據 原理求得n (H2O)
④該樣品晶體的化學式為
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知: NO3-+4H++3e-→NO+2H2O 。現有四種物質:KMnO4、Na2CO3、Cu2O、Fe2(SO4)3,其中能使上述還原過程發生的是 (填化學式),寫出該反應化學方程式中氧化產物的化學計量數(寫方框內)及其化學式□ 。1mol該物質與某濃度硝酸反應時,被還原硝酸的物質的量增加,原因是: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
利用化學原理對工廠排放的廢水、廢渣等進行有效檢測與合理處理。
(一)染料工業排放的廢水中含有大量有毒的NO2-,可以在堿性條件下加入鋁粉除去(加熱處理后的廢水會產生能使濕潤的紅色石蕊試紙變藍的氣體)。除去NO2-的離子方程式為________。
(二)某工廠對制革工業污泥中Cr(Ⅲ)回收與再利用工藝如下(硫酸浸取液中金屬離子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):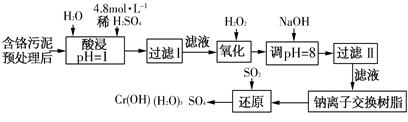
常溫下部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀 時的pH | 1.9 | 7.0 | — | — | 4.7 | — |
| 沉淀完全 時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
化合物KxFe(C2O4)y·3H2O(Fe為+3價)是一種光敏材料,實驗室可以用如下方法來制備這種材料并測定這種材料的組成: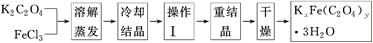
(1)結晶時應將溶液用冰水冷卻置于在黑暗處等待晶體的析出,這樣操作的原因是:________________________________________________________________________。
(2)操作Ⅰ的名稱是______________________。
(3)稱取一定質量的晶體置于錐形瓶中,加入足量的蒸餾水和稀H2SO4,將C2O42-轉化為H2C2O4后用0.100 0 mol·L-1KMnO4溶液滴定,當消耗KMnO4溶液24.00 mL時恰好完全反應,H2C2O4與酸性KMnO4溶液反應的化學方程式是:__________________________。再向溶液中加入適量的還原劑,恰好將Fe3+完全轉化為Fe2+,用KMnO4溶液繼續滴定。當Fe2+完全氧化時,用去KMnO4溶液4.00 mL,此滴定反應的離子方程式是____________。
(4)配制100 mL 0.100 0 mol·L-1KMnO4溶液及滴定實驗中所需的玻璃儀器除燒杯、玻璃棒、膠頭滴管、量筒、錐形瓶外還有________(填儀器名稱)。滴定終點時溶液顏色為________色,且30秒內不變色。
(5)經計算,化合物KxFe(C2O4)y·3H2O中,x=________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com