
CuSO4溶液與K2C2O4溶液混合生成一種藍色鉀鹽水合物KaCub(C2O4)c·nH2O。通過下述實驗確定該晶體的組成。
步驟a:稱取0.6720 g樣品,放入錐形瓶,加入適量2mol·L-1稀硫酸,微熱使樣品溶解。再加入30 mL水加熱,用0.2000mol·L-1 KMnO4溶液滴定至終點,消耗8.00 mL KMnO4溶液。有關反應:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步驟b:接著將溶液充分加熱。冷卻后,調節pH并加入過量的KI固體,溶液變為棕色并產生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3標準溶液滴定至終點,消耗8.00 mL Na2S2O3溶液。滴定時反應為:I2+2S2O32-=2I-+S4O62-
(1)步驟b中生成白色沉淀的離子方程式: 。
(2)步驟b中“將溶液充分加熱”的目的是 。
(3)請完成下列確定樣品組成的計算過程。
①計算樣品中n (C2O42-)(寫出計算過程)
②計算樣品中n (Cu2+) (寫出計算過程)
③根據 原理可求出n (K+),再依據 原理求得n (H2O)
④該樣品晶體的化學式為
(1)2Cu2++4I-=2CuI↓+I2 (2)除去微量的MnO4-,以免影響實驗結果的測定
(3)① 2MnO4- ~ 5C2O42- ② 2S2O32- ~ I2 ~ 2Cu2+
2 5 2 2
0.2×8×10-3mol 4×10-3mol 0.25×8×10-3mol 2×10-3mol
n (C2O42-)= 4×10-3mol n (Cu2+)= 2×10-3mol
③電荷守恒 質量守恒 ④K2Cu(C2O4)2·H2O
解析試題分析:(1)由Cu2+→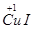 ~e-,2I-→I2~2e-,結合原子守恒和電荷守恒配平。
~e-,2I-→I2~2e-,結合原子守恒和電荷守恒配平。
(2)MnO4-與C2O42-發生氧化還原反應,加熱可使二者反應充分,防止MnO4-對后面的實驗干擾。
(3)①由關系式2MnO4- ~ 5C2O42-,n (C2O42-)=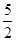 n (MnO4-)= 0.2×8×10-3mol= 4×10-3mol;
n (MnO4-)= 0.2×8×10-3mol= 4×10-3mol;
②由關系式2S2O32- ~ I2 ~ 2Cu2+,n (Cu2+)= n (S2O32-)= 0.25×8×10-3mol = 2×10-3mol
③電荷守恒式:n(K+)+2n(Cu2+)=2n( C2O42-),將n (Cu2+)= 2×10-3mol,n (C2O42-)= 4×10-3mol帶入,解得n(K+)=4×10-3mol;m(H2O)=m(樣品)-m (K+)- m(Cu2+)-m( C2O42-)。
④m(H2O)="0." 6720g-4×10-3mol×39g?mol-1-2×10-3mol×64g?mol-1-4×10-3mol×88 g?mol-1=0.036g
n(H2O)="0.036" g/(18 g?mol-1)="0." 002 mol,即n(K+): n(Cu2+): n( C2O42-):n(H2O)=2:1:2:1,即化學式為K2Cu(C2O4)2·H2O。
考點:考查晶體的組成測定,涉及到氧化還原反應的知識,掌握實驗的原理是解題的關鍵,難度中等。


 字詞句段篇系列答案
字詞句段篇系列答案科目:高中化學 來源: 題型:填空題
已知氧化還原反應與四種基本反應類型的關系可用如圖表示,下列是有水參加或生成的幾種反應:
①CaO+H2O =Ca(OH)2
②2Na+H2O=2NaOH+H2↑
③H2+CuO  Cu +H2O
Cu +H2O
④3S+6NaOH  2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH+HCl=NaCl+H2O
請回答下列問題:
(1)反應①中水 (填字母)。
| A.是氧化劑 |
| B.是還原劑 |
| C.既是氧化劑又是還原劑 |
| D.既不是氧化劑又不是還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
水是組成生命體的重要物質,有關水的反應實例有很多。
(1)有人設想將太陽能轉化為電能,進而將水電解生成氫氣,氫氣是一種清潔能源。請分析電解水的過程中,水是_____________(填僅被氧化,僅被還原,既被氧化又被還原,既不被氧化又不被還原)
(2)野營愛好者攜帶氫化鈣固體作為生氫劑,方程式為CaH2+2H2O=Ca(OH)2+2H2↑,其中水是_____________(填僅被氧化,僅被還原,既被氧化又被還原,既不被氧化又不被還原)
(3)在下列反應中水只被還原的是_____________(填序號)
| A.C+H2O=CO+H2 | B.CaO+H2O=Ca(OH)2 |
| C.3Fe+4H2O=Fe3O4+4H2 | D.3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氧化還原反應規律是化學學科的重要規律之一。按要求回答下列問題:
(1) 被稱為萬能還原劑的NaBH4溶于水并和水反應:NaBH4+2H2O=NaBO2+4H2↑,此反應中B元素的化合價沒有發生變化,則NaBH4中H的化合價為___________,該反應氧化產物是______________,還原產物是______________。
(2) 有下列三個反應:
①Cl2+FeI2=FeCl2+I2 ;②2Fe2++Br2=2Fe3++2Br-;③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
①根據以上方程式可以得到Fe2+、Co2+、Br-、I-還原性由強的弱的順序為_________;
②1molCo2O3能氧化HCl的物質的量_____________。
(3) 完成并配平下列化學反應方程式:
□KMnO4+□H2C2O4+□________ □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
(4)一個完整的氧化還原反應方程式可以拆寫成兩個“半反應式”,一個是“氧化反應式”,一個是“還原反應式”。如2H+ +Zn=Zn2++H2↑,可拆寫為氧化反應式:Zn-2e-=Zn 2+,還原反應式:2H++ 2e-=H2↑。并由此實現了化學能與電能的相互轉化。據此,回答下列問題:
①將2Fe3++Cu= 2Fe2+ +Cu2+拆寫為兩個“半反應式”:其中,氧化反應式為 。
②由①中的反應,可設計成如右圖所示的原電池:
若電極a為Cu ,電解質溶液甲的化學式為 ;
電極b處的電極反應式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
以下反應①②可用于從不同原料中提取碘:
①2NaI+MnO2+3H2SO4 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3 2Na2SO4+3NaHSO4+H2O+I2
2Na2SO4+3NaHSO4+H2O+I2
(1)反應①中的氧化劑是___________________;反應②中的還原產物是________________。
(2)根據反應①②可推知______。
a.氧化性:IO3->SO42- b.氧化性:MnO2>NaIO3
c.還原性:I->Mn2+ d.還原性:I2>NaHSO3
(3)已知NaI和NaIO3在酸性條件下能反應生成I2 ,寫出該反應的離子方程式:
③__________________________________________________________。
(4)三個反應中生成等量的I2時轉移的電子數最少的是反應________(填序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鈣是自然界存在最廣泛的IIA族元素,常以化合物N存在。從鈣單質起始發生的一系列化學反應可由下圖表示: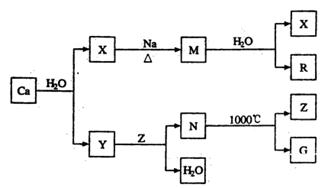
(1)鈣元素在周期表中位于第______周期;Y中存在的化學鍵類型為_______________;N的化學式是______________。
(2)M與水反應的化學方程式為______________________________________________.
(3)Z和G的電子式分別為_______________________和_________________________.
(4)Z與R反應可能生成的鹽有________________________________(填化學式)。
(5)實際生產中,可由N為原料制備單質鈣,簡述一種制備方法:
_________________________________________________________________________.
(6)金屬鈣線是煉制優質鋼材的脫氧脫磷劑。某鈣線的主要成分含Fe元素和Ca元素。
請配平下列用鈣線脫氧脫磷的化學方程式: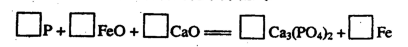
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某高溫還原法制備新型陶瓷氮化鋁(AlN)的反應體系中的物質有:Al2O3.C.N2.AlN.CO
(1)請將AlN之外的反應物與生成物分別填入以下空格內,配平,并標出電子轉移的方向和數目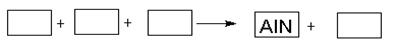
(2)若反應中共轉移3.01 ×1023個電子,則該反應產生氣體的體積為: (標準狀況下)
(3)氮化鋁也能由氯化鋁與氨氣經氣相反應制得:AlCl3+NH3  AlN+3HCl反應中,該方法比前者在生產上更具優勢。下列說法中,正確的是 。
AlN+3HCl反應中,該方法比前者在生產上更具優勢。下列說法中,正確的是 。
A.前一方法中的 Al2O3.C.N2結構穩定,反應時破壞化學鍵需要消耗更多的能量
B.前一方法中的Al2O3和C容易殘留在氮化鋁中
C.兩種方法中氮化鋁均為還原產物
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
2013年初,霧霾天氣多次肆虐我國中東部,該地區PM2.5嚴重超標。研究表明,PM2.5約60%來源于某些氣體污染物在空氣中轉變而成的二次顆粒物。這些氣體污染物主要有二氧化硫、氮氧化物、氨氣、揮發性有機物。因此,控制、治理PM2.5污染源成為環保的重要課題。
(1)研究表明,TiO2在紫外線照射下會使空氣中的某些分子產生活性基團OH,如圖所示,OH與NO2的反應為NO2+OH HNO3。寫出OH與NO反應的化學方程式:_____________,該反應中被氧化的元素是 。
HNO3。寫出OH與NO反應的化學方程式:_____________,該反應中被氧化的元素是 。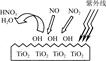
(2)如圖所示的電解裝置能吸收和轉化NO2、NO和SO2。陰極排出的溶液中含S2O42-離子,能吸收NOx氣體,生成的SO32-可在陰極區再生。請將S2O42-吸收NO2的離子方程式配平,并標明電子轉移的方向和數目。
____S2O42-+____NO2+____OH- SO32-+____N2+____
SO32-+____N2+____
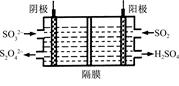
(3)已知上述電解裝置陽極反應為:SO2-2e-+2H2O SO42-+4H+,陰極生成的吸收液每吸收標準狀況下7.84 L的氣體,陽極區新生成質量分數為49%的硫酸100 g,則被吸收氣體中NO2和NO的物質的量之比為 。
SO42-+4H+,陰極生成的吸收液每吸收標準狀況下7.84 L的氣體,陽極區新生成質量分數為49%的硫酸100 g,則被吸收氣體中NO2和NO的物質的量之比為 。
(4)PM2.5產生的主要來源是日常發電、工業生產、汽車尾氣排放等過程中經過燃燒而排放的殘留物,大多含有重金屬等有毒物質。一般而言,粒徑2.5微米至10微米的粗顆粒物主要來自揚塵等;2.5微米以下的細顆粒物(PM2.5)則主要來自化石燃料的燃燒(如機動車尾氣、燃煤)、揮發性有機物的排放等。請你結合信息,給出降低PM2.5排放的對策(至少兩條): ______ 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
為驗證鹵素單質氧化性的相對強弱,某小組用下圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢驗)。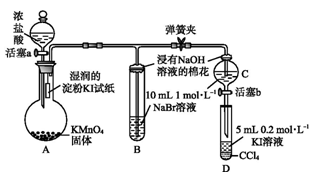
實驗過程:
Ⅰ.打開彈簧夾,打開活塞a,滴加濃鹽酸。
Ⅱ.當B和C中的溶液都變為黃色時,夾緊彈簧夾。
Ⅲ.當B中溶液由黃色變為棕紅色時,關閉活塞a。
Ⅳ.……
(1)A中產生黃綠色氣體,其化學方程式是 。
(2)驗證氯氣的氧化性強于碘的實驗現象是 。
(3)B中溶液發生反應的離子方程式是 。
(4)為驗證溴的氧化性強于碘,過程Ⅳ的操作和現象是 。
(5)過程Ⅲ實驗的目的是 。
(6)氯、溴、碘單質的氧化性逐漸減弱的原因:同主族元素從上到下 ,得電子能力逐漸減弱。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com