
| A. | 0.1mol的OH-中含有的電子數為0.9NA | |
| B. | 標準狀況下,11.2 L CCl4所含分子數為0.5NA | |
| C. | 6.02×1022個 CH4所含氫原子數為0.4NA | |
| D. | 常溫常壓下,28 g N2中所含原子個數為NA |
分析 A.氫氧根離子中含有10個電子,0.1mol氫氧根離子含有1mol電子;
B.標準狀況下四氯化碳不是氣態;
C.根據阿伏伽德羅常數NA=6.02×1023計算;
D.根據n=$\frac{m}{M}$計算出氮氣的物質的量,然后可計算出含有N原子數.
解答 解:A.0.1mol的OH-中含有1mol電子,含有的電子數為NA,故A錯誤;
B.標準狀況下,四氯化碳不是氣體,不能使用標準狀況下的氣體摩爾體積計算,故B錯誤;
C.6.02×1022個 CH4所含氫原子數為:6.02×1022×4=0.4NA,故C正確;
D.28g氮氣的物質的量為:$\frac{28g}{28g/mol}$=1mol,1mol氮氣分子中含有2molN原子,所含原子個數為2NA,故D錯誤;
故選C.
點評 本題考查阿伏加德羅常數的應用,題目難度中等,注意掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,明確標準狀況下氣體摩爾體積的使用條件,試題有利于培養學生的邏輯推理能力,提高學生靈活運用基礎知識解決實際問題的能力.


科目:高中化學 來源: 題型:實驗題
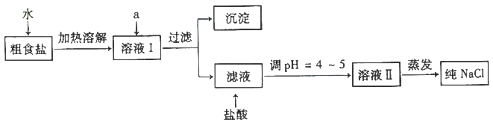
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.01mol/L的氨水 | B. | 0.01mol/L的NaOH | ||
| C. | 0.01mol/L的CH3COOH | D. | 0.01mol/L的HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鉛蓄電池充電時,陰極反應式為:PbSO4+2e-=Pb+SO42- | |
| B. | 用鋅片做陽極,鐵片做陰極,電解氯化鋅溶液,鐵片表面出現一層鋅 | |
| C. | 鋼柱在水下部分比在空氣與水交界處更容易腐蝕 | |
| D. | 把鋅粒放入盛有鹽酸的試管中,加入幾滴氯化銅溶液,氣泡放出速率加快 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
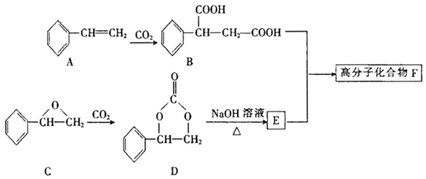
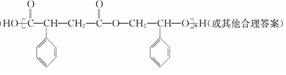
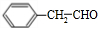 ,G與新制的Cu(OH)2懸濁液混合加熱時發生反應的化學方程式為
,G與新制的Cu(OH)2懸濁液混合加熱時發生反應的化學方程式為
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第二周期元素氫化物的穩定性順序是:HF>H2O>NH3;則第三周期元素氫化物的穩定性順序也是:HCl>H2S>PH3 | |
| B. | IVA族元素氫化物沸點順序是:GeH4>SiH4>CH4;則VA族元素氫化物沸點順序也是:AsH3>PH3>NH3 | |
| C. | 氯最高價氧化物對應的水化物為HClO4;則氟最高價氧化物對應的水化物HFO4 | |
| D. | NaHSO4與NaHSO3溶于水顯酸性,由所有酸式鹽溶于水顯酸性 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com