
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始濃度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡濃度(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min內,v(Cl2)=0.04 mol/(L•min) | |
| B. | 當容器中Cl2為1.2 mol時,反應達到平衡 | |
| C. | 升高溫度(T1<T2),反應的平衡常數減小,平衡時PCl3的$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同條件下再達平衡時,c(PCl5)<0.2 mol/L |
分析 A.由表中數據可知,平衡時△c(PCl5)=0.4mol/L,根據方程式可知△c(PCl3)=0.4mol/L,根據v=$\frac{△c}{△t}$計算v(PCl3);
B.平衡時△c(PCl5)=0.4mol/L,根據方程式可知△c(Cl2)=0.4mol/L,根據△n=△c×V計算△n(Cl2),進而計算平衡時Cl2的物質的量;
C.升高溫度,反應的平衡常數減小,平衡向逆反應移動;
D、平衡后移走2.0mol PCl3和1.0mol Cl2到達的平衡,等效為開始PCl3為1mol/L、Cl2為0.5mol/L到達平衡,與原平衡相比,壓強降低,平衡向逆反應移動,反應物轉化率降低.
解答 解:A.由表中數據可知,平衡時△c(PCl5)=0.4mol/L,根據方程式可知△c(PCl3)=0.4mol/L,v(PCl3)=$\frac{0.4mol/L}{10min}$=0.04mol•L-1•min-1,故A正確;
B.平衡時△c(PCl5)=0.4mol/L,根據方程式可知△c(Cl2)=0.4mol/L,△n(Cl2)=0.4mol/L×2L=0.8mol,故平衡時Cl2的物質的量為1mol/L×2L-0.8mol=1.2mol,故B正確;
C.升高溫度,反應的平衡常數減小,平衡向逆反應移動,PCl3轉化率降低,△n減小,故平衡時PCl3的$\frac{△n({T}_{1})}{△n({T}_{2})}$>1,故C錯誤;
D、平衡后移走2.0mol PCl3和1.0mol Cl2到達的平衡,等效為開始PCl3為1mol/L、Cl2為0.5mol/L到達平衡,反應物的濃度變為原平衡的一半,與原平衡相比,壓強降低,平衡向逆反應移動,反應物轉化率降低,故相同條件下再達平衡時,c(PCl5)<0.2 mol•L-1,故D正確;
故選C.
點評 本題考查化學平衡常數的應用、化學平衡的有關計算等,難度中等,注意D選項中構建平衡建立的途徑.


科目:高中化學 來源: 題型:解答題
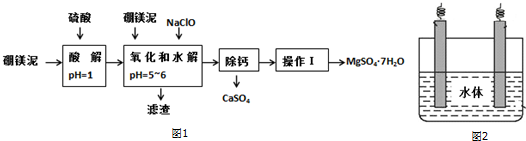
| 氫氧化物 | 開始沉淀時的pH | 完全沉淀時的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 溫度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
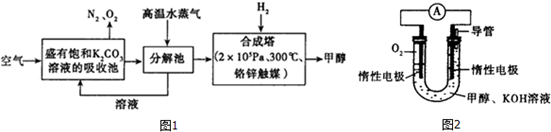
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需要的時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑥ | B. | ③④⑥ | C. | ②③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com