
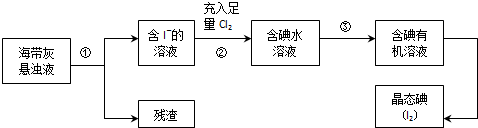
分析 海帶灰懸濁液過濾得到含I-的溶液,溶液中充入足量的氯氣氧化碘離子為碘單質,加入萃取劑萃取分液得到含碘有機溶液,蒸餾得到碘單質,
(1)根據儀器的作用選取儀器,灼燒用坩堝,轉移坩堝用坩堝鉗,用帶鐵圈的鐵架臺或三腳架和泥三角上放置坩堝,用酒精燈進行加熱;
(2)過濾后的濾液中含碘離子,充入足量Cl2可以被氧化為碘單質;
(3)萃取劑的選取標準是:溶質在萃取劑中的溶解度大于在原溶劑中的溶解度,溶質和萃取劑不反應,萃取劑和原來溶劑不能互溶;
(4)a.不打開活塞,液體在大氣壓作用下無法流出;
b.上層液體從上口倒出,下層液體從下口流出;
(5)根據碘單質遇到淀粉會變藍色來檢驗是否還有碘單質;
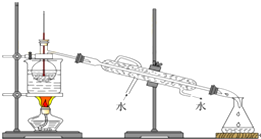
(6)冷凝水應是下進上出,溫度計水銀球應與燒瓶支管口相平,大面積加熱玻璃儀器需要墊石棉網;
(7)水浴加熱的溫度是使試管內或燒杯內試劑受熱溫度均勻,具有長時間加熱溫度保持恒定的特點.
解答 解:(1)灼燒海帶時用坩堝盛放海帶,用帶鐵圈的鐵架臺或三腳架和泥三角上放置坩堝,用酒精燈進行加熱,所以灼燒海帶時需要用到的實驗儀器是坩堝、帶鐵圈的鐵架臺或三腳架、泥三角、酒精燈,用坩堝鉗轉移坩堝,無需使用燒杯,
故答案為:ABCDE;
(2)步驟②用氯氣置換碘離子,其反應離子方程式為Cl2+2I-=I2+2Cl-;
故答案為:使I-轉化為I2,Cl2+2I-=I2+2Cl-;
(3)碘在萃取劑CCl中的溶解度大于在原溶劑水中的溶解度,碘和四氯化碳不反應,四氯化碳和水不能互溶,所以可以用四氯化碳作萃取劑,
故答案為:CCl4;
(4)a.不打開活塞,液體在大氣壓作用下無法流出,
故答案為:保持分液漏斗內外壓力平衡,使液體易于流下;
b.上層液體從上口倒出,下層液體從下口流出;CCl4 的密度大于水的密度,故從漏斗下口流出,
故答案為:漏斗下口;
(5)提取碘后的水溶液中若是含有單質碘,則遇到淀粉會變藍色,可以取少量提取碘后的水溶液于試管中,加入幾滴淀粉試液,觀察是否出現藍色(如果變藍,說明還有單質碘),
故答案為:淀粉溶液;
(6)冷凝水應是下進上出,溫度計測量蒸氣的溫度,溫度計水銀球應與燒瓶支管口相平,燒杯加熱需要墊石棉網,其錯誤有3處,
故答案為:3;
(7)水浴加熱的溫度是使試管內或燒杯內試劑受熱溫度均勻,具有長時間加熱溫度保持恒定的特點,四氯化碳沸點:76.8℃,碘單質沸點為184℃,所以最后晶態碘在蒸餾燒瓶里聚集,
故答案為:受熱比較均勻,溫度容易控制;
點評 本題考查了海水資源的綜合利用,為高頻考點,涉及知識點較多,把握實驗流程及發生的反應、萃取劑的選取標準、蒸餾實驗原理及裝置等知識點為解答的關鍵,側重高頻考點的考查,題目難度中等.


 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 這種飲料中不含任何化學物質 | |
| B. | 沒有水就沒有生命 | |
| C. | 這種口服液含豐富的氮、磷、鋅等微量元素 | |
| D. | 這種蒸餾水絕對純凈,其中不含任何離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2:l | B. | 2:2:1 | C. | 2:3:l | D. | 4:3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com