【答案】
分析:(1)加熱條件下,二氧化錳和濃鹽酸發生氧化還原反應生成氯氣,根據元素化合價是否變化確定鹽酸的作用,注意濃鹽酸和二氧化錳反應生成氯氣,但稀鹽酸和二氧化錳不反應;
(2)氯氣有毒,但能和強堿反應;
(3)氯氣和氫氧化鈣反應生成氯化鈣、次氯酸鈣;
(4)根據題意知,降低溫度即可;氫氧化鈣能和氯化氫反應生成氯化鈣.
解答:解:(1)①加熱條件下,二氧化錳和濃鹽酸發生氧化還原反應生成氯氣,反應方程式為:MnO
2+4HCl(濃)
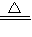
MnCl
2+2H
2O+Cl
2↑;
②該反應中,部分氯元素化合價升高,部分化合價不變,所以鹽酸有還原性和酸性,故選ac;
③濃鹽酸和二氧化錳反應生成氯氣,但稀鹽酸和二氧化錳不反應,且參加反應的鹽酸有一半參加氧化還原反應,所以若有0.4molHCl參加反應,可制得氯氣2.24L,故選C;
故答案為:MnO
2+4HCl(濃)
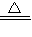
MnCl
2+2H
2O+Cl
2↑;ac;C;
(2)氯氣有毒不能直接排空,但氯氣能和氫氧化鈉反應生成無毒物質,所以D中試劑是氫氧化鈉溶液,
故答案為:NaOH溶液,吸收氯氣等尾氣,防止污染環境;
(3)氯氣和氫氧化鈣反應生成氯化鈣、次氯酸鈣和水,反應方程式為:2Cl
2+2Ca(OH)
2=Ca(ClO)
2+CaCl
2+2H
2O,故答案為:2Cl
2+2Ca(OH)
2=Ca(ClO)
2+CaCl
2+2H
2O;
(4)①溫度較高時氯氣與消石灰反應生成了Ca(ClO
3)
2,為避免副反應發生,應該降低溫度,所以可以采取將U型管置于冷水浴中的措施,
故答案為:將U型管置于冷水浴中;
②鹽酸易揮發,加熱過程中生成的氯氣中含有氯化氫,氯化氫能和堿反應,所以反應方程式為:Ca(OH)
2+2HCl=CaCl
2+2H
2O,為避免副反應發生,可以在B、C之間連接一個盛有飽和食鹽水的洗氣瓶,
故答案為:Ca(OH)
2+2HCl=CaCl
2+2H
2O;在B、C之間連接一個盛有飽和食鹽水的洗氣瓶.
點評:本題考查了氯氣的實驗室制法、尾氣的處理等知識點,注意濃鹽酸和二氧化錳反應但稀鹽酸不和二氧化錳反應,為易錯點.


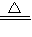 MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;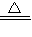 MnCl2+2H2O+Cl2↑;ac;C;
MnCl2+2H2O+Cl2↑;ac;C;

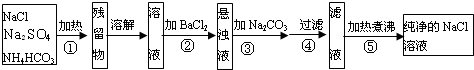
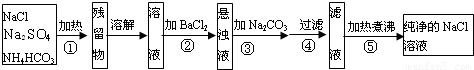
 某學生設計如圖所示實驗裝置利用氯氣與潮濕的消石灰反應制取少量漂白粉(這是一個放熱反應,反應后溫度將升高),A中盛濃鹽酸,C中盛潮濕的消石灰,據此回答下列問題:
某學生設計如圖所示實驗裝置利用氯氣與潮濕的消石灰反應制取少量漂白粉(這是一個放熱反應,反應后溫度將升高),A中盛濃鹽酸,C中盛潮濕的消石灰,據此回答下列問題: