
【題目】
銅礦( CuFeS2)是煉銅的最主要礦物。火法冶煉黃鋼礦的過程中,其中一步反應是:2Cu2O+Cu2S![]() 6Cu+SO2。回答下列問題。
6Cu+SO2。回答下列問題。
(1)Cu+價電子的電子排布圖為___________,Cu2O與Cu2S比較,熔點較高的是___________,原因為______________________。
(2)SO2與SO3的鍵角相比,鍵角更小的是___________。某種硫的氧化物冷卻到289.8K時凝固得到一種螺旋狀單鏈結構的固體,其結構片段如圖1所示。此固態物質中S原子的雜化軌道類型是___________;該物質的化學式為___________。

(3)離子化合物CaC2的晶體結構如圖2所示。寫出該物質的電子式___________。從鈣離子看該晶體屬于___________堆積,一個晶胞含有的π鍵平均有___________個。

(4)根據圖3可知,與每個C60分子距離最近且相等的C60分子有___________個,其距離為___________cm(列出計算式即可)。

【答案】![]() Cu2O 兩物質均為離子化合物,且離子所帶電荷數相同,O2-半徑小于S2-,所以Cu2O的晶格能大,熔點更高 SO2 sp3 SO3或(SO3)n
Cu2O 兩物質均為離子化合物,且離子所帶電荷數相同,O2-半徑小于S2-,所以Cu2O的晶格能大,熔點更高 SO2 sp3 SO3或(SO3)n ![]() 面心立方 8 12
面心立方 8 12 ![]()
【解析】
(1)Cu位于第四周期IB族,Cu+的價電子為第三層的d能級,根據泡利原理和洪特規則,書寫價電子軌道式;Cu2O和Cu2S都屬于離子晶體,晶格能越大,晶體熔沸點越高,據此分析作答;
(2)孤電子對之間的斥力>孤電子對-成鍵電子對之間的斥力>成鍵電子對之間斥力,據此分析鍵角大小;利用均攤法求出圖1中的化學式組成,再請根據雜化軌道類型判斷其雜化方式;
(3)碳化鈣中存在離子鍵與非極性共價鍵,據此寫出其電子式;結合金屬原子常見堆積模型作答;再根據均攤法計算所含π鍵數目。
(1)Cu位于第四周期IB族,Cu+的價電子為第三層的d能級,根據泡利原理和洪特規則,Cu+價電子軌道式為![]() ;Cu2O和Cu2S都屬于離子晶體,晶格能越大,晶體熔沸點越高,晶格能與半徑、所帶電荷數有關,半徑越小、所帶電荷數越多,晶格能越大,Cu2O和Cu2S所帶電荷數相同,S2-的半徑大于O2-的半徑,因此Cu2S的沸點低于Cu2O;
;Cu2O和Cu2S都屬于離子晶體,晶格能越大,晶體熔沸點越高,晶格能與半徑、所帶電荷數有關,半徑越小、所帶電荷數越多,晶格能越大,Cu2O和Cu2S所帶電荷數相同,S2-的半徑大于O2-的半徑,因此Cu2S的沸點低于Cu2O;
故答案為![]() ;Cu2O;兩物質均為離子化合物,且離子所帶電荷數相同,O2-半徑小于S2-,所以Cu2O的晶格能大,熔點更高;
;Cu2O;兩物質均為離子化合物,且離子所帶電荷數相同,O2-半徑小于S2-,所以Cu2O的晶格能大,熔點更高;
(2)SO2含有的孤電子對為(6-2×2)/2=1,SO3中含有孤電子對為(6-2×3)/2=0,孤電子對之間的斥力>孤電子對-成鍵電子對之間的斥力>成鍵電子對之間斥力,因此SO3鍵角大于SO2鍵角;根據圖1可知,該固體結構的基本單元中含S原子數目為1個,O原子數目為![]() =3個,所以其化學式為SO3或(SO3)n,又因為中心S有4個σ鍵,無孤電子對,價層電子對數為4,雜化軌道數等于價層電子對數,即雜化類型為sp3;
=3個,所以其化學式為SO3或(SO3)n,又因為中心S有4個σ鍵,無孤電子對,價層電子對數為4,雜化軌道數等于價層電子對數,即雜化類型為sp3;
故答案為SO2;sp3;SO3或(SO3)n;
(3)根據圖2,CaC2的電子式為:![]() ;根據晶胞的結構,Ca2+位于頂點和面心,因此屬于面心立方堆積;C22-位于棱上和體心,屬于晶胞的C22-的個數為12×1/4+1=4,根據CaC2的電子式,兩個碳原子之間有3對電子對,即1個C22-有2個π鍵,即1個晶胞中有2×4=8個π鍵;
;根據晶胞的結構,Ca2+位于頂點和面心,因此屬于面心立方堆積;C22-位于棱上和體心,屬于晶胞的C22-的個數為12×1/4+1=4,根據CaC2的電子式,兩個碳原子之間有3對電子對,即1個C22-有2個π鍵,即1個晶胞中有2×4=8個π鍵;
故答案:![]() ;面心立方; 8。
;面心立方; 8。
(4)根據圖3,與每個C60分子距離最近且相等的C60分子有12個,其距離等于邊長的![]() ,所以其距離 =
,所以其距離 = ![]() ,
,
故答案為12;![]() 。
。


科目:高中化學 來源: 題型:
【題目】根據反應KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)設計如下原電池,其中甲、乙兩燒杯中各物質的物質的量濃度均為1 mol·L-1,溶液的體積均為200 mL,鹽橋中裝有飽和K2SO4溶液。下列說法不正確的是( )

A.石墨b是原電池的負極,發生氧化反應
B.忽略溶液體積變化,Fe2(SO4)3濃度變為1.5 mol/L,則反應中轉移的電子為0.1 mol
C.甲燒杯中的電極反應式:MnO4-+5e-+8H+=Mn2++4H2O
D.電池工作時,鹽橋中的K+向甲燒杯中移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個體積為2L的密閉容器中,高溫下發生反應:C(s)+H2O(g)![]() CO(g)+H2(g),其中,H2O、CO的物質的量隨時間的變化曲線如下圖所示。
CO(g)+H2(g),其中,H2O、CO的物質的量隨時間的變化曲線如下圖所示。
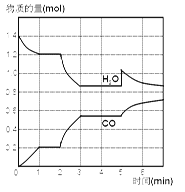
(1)寫出上述反應的平衡常數表達式K=______。
(2)計算第1min內v(H2O)=_______。
(3)反應處于平衡狀態的時間段是_______。
(4)若反應進行至2min時,改變了溫度,使曲線發生了如下圖所示的變化,則溫度是____,(填“升高、降低、不變”),正反應是_____(填“吸熱、放熱”)反應。
(5)反應至5min時,若也只改變了某一個條件,使曲線發生如上圖所示的變化,該條件可能是下述中的____(填寫編號)。
①增加了CO; ②增加了水蒸氣; ③加了催化劑; ④擴大了容器體積。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物F是一種藥物合成的中間體,F的一種合成路線如下:

已知:

回答下列問題:
(1)![]() 的名稱為____。
的名稱為____。
(2)D中含氧官能團的名稱為____。
(3)B→C的反應方程式為____。
(4)D→E的反應類型為____。
(5)C的同分異構體有多種,其中苯環上連有—ONa、2個—CH3的同分異構體還有____種,寫出核磁共振氫譜為3組峰,峰面積之比為6:2:1的同分異構體的結構簡式____。
(6)依他尼酸鈉( )是一種高效利尿藥物,參考以上合成路線中的相關信息,設計以
)是一種高效利尿藥物,參考以上合成路線中的相關信息,設計以![]() 為原料(其他原料自選)合成依他尼酸鈉的合成路線。________________
為原料(其他原料自選)合成依他尼酸鈉的合成路線。________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種以黃銅礦和硫磺為原料制取銅和其他產物的新工藝,原料的綜合利用率較高。其主要流程如下:
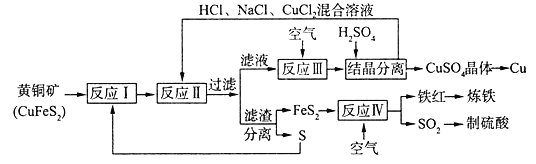
已知:“反應Ⅱ”的離子方程式為Cu2++CuS+4C1-==2[CuCl2]-+S
回答下列問題:
(1)鐵紅的化學式為__________________;
(2)“反應Ⅱ”的還原劑是_______________(填化學式);
(3)“反應III”的離子方程式為____________________________________;
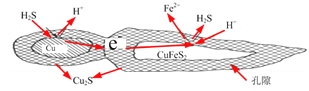
(4)輝銅礦的主要成分是Cu2S,可由黃銅礦(主要成分CuFeS2)通過電化學反應轉變而成,有關轉化如下如圖 所示。轉化時正極的電極反應式為___________________。
(5)從輝銅礦中浸取銅元素,可用FeCl3作浸取劑。
①反應Cu2S+4FeCl32CuCl2+4FeCl2+S,每生成1mol CuCl2,反應中轉移電子的數目為______;浸取時,在有氧環境下可維持Fe3+較高濃度。有關反應的離子方程式是__________。
②浸取過程中加入洗滌劑溶解硫時,銅元素的浸取率的變化如圖,其原因是_______________。

(6)CuCl懸濁液中加入Na2S,發生的反應為2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq),該反應的平衡常數K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
Cu2S(s)+2Cl-(aq),該反應的平衡常數K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在體積為V L的恒容密閉容器中盛有一定量H2,通入Br2(g)發生反應H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。當溫度分別為T1、T2,平衡時,H2的體積分數與Br2(g)的物質的量變化關系如圖所示。下列說法正確的是
2HBr(g);ΔH<0。當溫度分別為T1、T2,平衡時,H2的體積分數與Br2(g)的物質的量變化關系如圖所示。下列說法正確的是
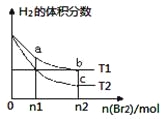
A. 若b、c點的平衡常數分別為K1、K2,則K1>K2
B. a、b兩點的反應速率:b>a
C. 為了提高Br2(g)的轉化率,可采取增加Br2(g)通入量的方法
D. 若平衡后保持溫度不變,壓縮容器體積平衡一定不移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中,一定條件下進行如下反應2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,達到平衡后,為提高該反應的速率和NO的轉化率,采取的正確措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,達到平衡后,為提高該反應的速率和NO的轉化率,采取的正確措施是( )
A.加催化劑同時升高溫度B.加催化劑同時增大壓強
C.升高溫度同時充入N2D.降低溫度同時增大壓強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在國慶70周年慶典上,空中飛過的殲擊機編隊讓我們熱血沸騰,其中有中國自主研制的最先進的殲20隱形超音速飛機。當超音速飛機在平流層飛行時,尾氣中的NO會破壞臭氧層,,或許通過測定局部的臭氧濃度變化可使飛機不再“隱形”。因此科學家正在研究利用催化技術將尾氣中的NO和CO轉變成CO2和N2,化學方程式如下:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。請回答下列問題:
2CO2(g)+N2(g) △H<0。請回答下列問題:
(1)該反應的平衡常數表達式為___________________________。
(2)假設在閉容器發生上述反應,達到平衡后采取下列選項的措施既能加快反應速率又能提高NO轉化率的是_____________。
A.選用更有效的催化劑同時增加CO的量 B.升高反應體系的溫度
C.及時加入堿石灰 D.縮小容器的體積
(3)研究表明:在使用等質量催化劑時,增大催化劑比表面積可提高化學反應速率。為了分別驗證溫度、催化劑比表面積對化學反應速率的影響規律,某同學將等物質的量的NO和CO充入容積為2L的恒容密閉容器中,設計了三組實驗,部分實驗數據已經填在下面實驗設計表中。
實驗編號 | T/℃ | NO初始濃度/mol·L-1 | NO平衡濃度/mol·L-1 | 催化劑的比表面積/m2·g-1 |
Ⅰ | 280 | 0.3 | 0.1 | 82 |
Ⅱ | T1 | c1 | c2 | 124 |
Ⅲ | 350 | c3 | c4 | 124 |
①在上述表格的實驗條件數據中,T1=____________,c3=_____________。
②平衡時若保持溫度T1℃不變,再向容器中充入CO和CO2各0.2mol,則平衡將_________移動(填“向左”“向右”或“不”)
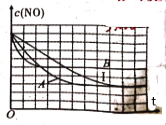
③在給出的坐標圖中,畫出了上表中的I、Ⅱ、Ⅲ實驗條件下建立平衡過程中,混合氣體里NO濃度隨時間變化的趨勢曲線圖,請說出B曲線對應的實驗編號__________(填Ⅱ、Ⅲ)。
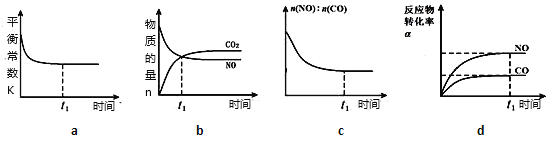
(4)在恒溫恒容的密閉容器中通入n(NO):n(CO)=1:3的混合氣體,發生上述反應,下列圖像正確且能說明反應在進行到t1時刻一定達到平衡狀態的是__________(選填字母)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:
①I2(g)+H2(g)![]() 2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g)![]() 2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判斷正確的是( )
A.254 g I2(g)中通入2 g H2(g),反應放熱9.48 kJ
B.I2(g)=I2(s) ΔH=-17.00 kJ/mol
C.固態碘的穩定性比氣態碘的穩定性高
D.1 mol固態碘和1 mol氣態碘分別與氫氣完全反應,前者斷裂的I—I鍵更多
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com