
短周期元素X、Y、Z、W、Q的原子序數依次增大,且只有一種金屬元素。其中X與W處于同一主族,Z元素原子半徑在短周期中最大(稀有氣體除外),W、Z之間與W、Q之間原子序數之差相等,五種元素原子最外層電子數之和為21,下列說法正確的是
| A.Y的簡單離子半徑小于Z的簡單離子半徑 |
| B.Z最高價氧化物對應的水化物分別與X、Y最高價氧化物對應的水化物反應生成1mol水時所放出的熱量相同 |
| C.Q可分別與X、Y、Z、W形成化學鍵類型相同的化合物 |
| D.Y的氣態氫化物在一定條件下可被Q單質氧化 |
D
解析試題分析:Z元素原子半徑在短周期中最大(稀有氣體除外),作為Z是鈉元素。短周期元素X、Y、Z、W、Q的原子序數依次增大,所以Z、W、Q處于第三周期。又因為W、Z之間與W、Q之間原子序數之差相等,且只有鈉是金屬元素,所以W、Q只能是硅和氯元素。X與W處于同一主族,則X是碳元素。五種元素原子最外層電子數之和為21,則Y元素的最外層電子數是21-4-1-4-7=5,則Y是氮元素。A、核外電子排布相同的微粒,其微粒半徑隨原子序數的增大而減小,則Y的簡單離子半徑大于Z的簡單離子半徑,A不正確;B、碳酸是弱酸,存在電離平衡,電離是吸熱的,因此Z最高價氧化物對應的水化物分別與X、Y最高價氧化物對應的水化物反應生成1mol水時所放出的熱量不相同,B不正確;C、Q可分別與X、Y、Z、W形成化學鍵類型分別為極性鍵、極性鍵、離子鍵、極性鍵,C不正確;D、氨氣在一定條件下拷貝氯氣氧化生成氮氣和氯化氫,D正確,答案選D。
考點:考查位置、結構與性質的有關判斷與應用


 精英口算卡系列答案
精英口算卡系列答案 應用題點撥系列答案
應用題點撥系列答案 狀元及第系列答案
狀元及第系列答案 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:單選題
對充有氖氣的霓虹燈管通電,燈管發出紅色光。產生這一現象的主要原因( )
| A.在電流的作用下,氖原子與構成燈管的物質發生反應 |
| B.電子由基態向激發態躍遷時吸收除紅光以外的光線 |
| C.氖原子獲得電子后轉變成發出紅光的物質 |
| D.電子由激發態向基態躍遷時以光的形式釋放能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列微粒半徑大小比較正確的是:
| A.Na+<Mg2+<Al3+<O2- | B.S2->Cl->Na+>Al3+ |
| C.Na<Mg<Al<S | D.Ca<Rb<K<Na |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如下圖。已知W的一種核素的質量數為18,中子數為10;X和Ne原子的核外電子數相差1;Y的單質是一種常見的半導體材料;Z的非金屬性在同周期元素中最強。下列說法正確的是
| A.對應簡單離子半徑:X>W |
| B.對應氣態氫化物的穩定性Y>Z |
| C.化合物XZW既含離子鍵,又含共價鍵 |
| D.Y的氧化物能與Z的氫化物和X的最高價氧化物對應的水化物的溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列敘述正確的是
| A.正戊烷與異戊烷互為同系物 |
| B.不同元素的原子形成的分子只含極性共價鍵 |
C.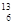 C和 C和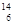 C是中子數不同質子數相同的同種核素 C是中子數不同質子數相同的同種核素 |
| D.短周期第IA與ⅦA族元素既可以形成離子化合物,也可以形成共價化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
短周期元素X、Y、Z、W、Q在元素周期表中的相對位置如圖所示。下列說法正確的是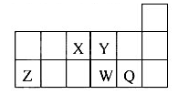
A 元素X與元素Z的最高正化合價之和的數值等于8
B 原子半徑的大小順序為:rX>rY>rZ>rW>rQ
C 離子Y2-和Z 3+的核外電子數和電子層數都不相同
D 元素W的最高價氧化物對應的水化物的酸性比Q的強
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
.我國稀土資源豐富。下列有關稀土元素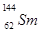 與
與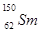 的說法正確的是
的說法正確的是
A.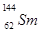 與 與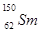 互為同位素 互為同位素 |
B.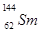 與 與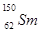 的質量數相同 的質量數相同 |
C.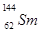 與 與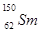 是同一種核素 是同一種核素 |
D.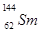 與 與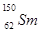 的核外電子數和中子數均為62 的核外電子數和中子數均為62 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
短周期元素甲、乙、丙、丁的原子序數依次增大,甲和乙形成的氣態化合物的水溶液呈堿性,乙位于第VA族,甲和丙同主族,丁原子最外層電子數與電子層數相等,則
| A.原子半徑:丙>丁>乙 |
| B.單質的還原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均為共價化合物 |
| D.乙、丙、丁的最高價氧化物對應的水化物不能相互反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com