
碘在不同狀態(tài)下(固態(tài)或氣態(tài))與氫氣反應的熱化學方程式如下所示:
①H2(g) + I2(?) 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判斷正確的是
| A.①中的I2為固態(tài),②中的I2為氣態(tài) |
| B.②的反應物總能量比①的反應物總能量低 |
| C.①的產物比反應②的產物熱穩(wěn)定性更好 |
| D.1mol 固態(tài)碘升華時將吸熱17kJ |
 小學教材完全解讀系列答案
小學教材完全解讀系列答案科目:高中化學 來源: 題型:單選題
鍵能是指斷開1mol共價鍵吸收的能量或形成1mol共價鍵放出的能量,已知H-H鍵能為436kJ/mol,H-Cl鍵能為431kJ/mol,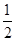 H2(g)+
H2(g)+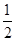 Cl2(g)=HCl(g) △H=-akJ/mol則Cl-Cl鍵能為
Cl2(g)=HCl(g) △H=-akJ/mol則Cl-Cl鍵能為
| A.(2a-426)kJ/mol | B.(426-a)kJ/mol |
| C.(426-2a)kJ/mol | D.(426+a)kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知在1×105Pa,298K條件下,1mol氫氣燃燒生成水蒸氣放出242kJ熱量,下列熱化學方程式正確的是
| A.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1 |
| B.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)ΔH=-484kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
肼(N2H4)是一種可用于火箭或原電池的燃料。已知:
N2(g) + 2O2(g) =2 NO2(g) ΔH =" +67.7kJ/mol" ①
N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -534 kJ/mol ②
下列說法正確的是
| A.反應①中反應物所具有的總能量大于生成物所具有的總能量 |
| B.2N2H4(g) + 2NO2(g) = 3N2(g)+ 4H2O (g) ΔH = -1000.3kJ/mol |
| C.鉑做電極,KOH溶液做電解質溶液,由反應②設計的燃料電池其負極反應式:N2H4-4e-+4OH-=N2+4H2O |
| D.鉑做電極,KOH溶液做電解質溶液,由反應②設計的燃料,工作一段時間后,KOH溶液的pH將增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
以下關于下圖說法正確的是
| A.如圖表明催化劑可以改變反應的熱效應 |
| B.如圖表示某反應能量的變化與生成物狀態(tài)無關 |
| C.如圖表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化 |
| D.如圖表明化學反應不僅遵循質量守恒定律,也遵循能量守恒 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
將1000 mL 0.1 mol·L-1 BaCl2溶液與足量稀硫酸充分反應放出a kJ熱量;將1000 mL 0.5 mol·L-1 HCl溶液與足量CH3COONa溶液充分反應放出b kJ熱量(不考慮醋酸鈉水解);將500 mL 1 mol·L-1 H2SO4溶液與足量(CH3COO)2Ba(可溶性強電解質)溶液反應放出的熱量為
| A.(5a-2b) kJ | B.(2b-5a) kJ |
| C.(5a+2b) kJ | D.(10a+4b) kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
將盛有NH4HCO3粉末的小燒杯放入盛有少量醋酸的大燒杯中。然后向小燒杯中加入鹽酸,反應劇烈,醋酸逐漸凝固。由此可見
| A.NH4HCO3和鹽酸的反應是放熱反應 |
| B.該反應中,熱能轉化為產物內部的能量 |
| C.反應物的總能量高于生成物的總能量 |
| D.反應的熱化學方程式為:NH4HCO3+HCl→NH4Cl+CO2↑+H2O △H﹤0 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知:HCN(aq)與NaOH(aq)反應的ΔH=-12.1 kJ·mol-1;HCl(aq)與NaOH(aq)反應的ΔH=-57.3 kJ·mol-1,則HCN在水溶液中電離的ΔH等于 ( )。
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com