解:(1)題中反應原理(1)IO
3-+5I
-+6H
+→3I
2+3H
2O、(2)I
2+2S
2O
32-═2I
-+S
4O
62-,結合滴定過程,需要用淀粉做指示劑,還缺少碘化鉀溶液,
故答案是:淀粉、KI溶液;
(2)根據質量要求達到0.001g,需要使用電子天平,還需要100mL容量瓶,
故答案是:100mL容量瓶、電子天平;
(3)加入的碘化鉀溶液必須過量,才能使KIO
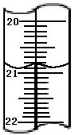
3與KI反應完全;滴定管的每個小刻度線是0.10ml,兩個滴定管讀數相差0.10,讀數應該是:20.80mL,
故答案是:過量;20.80;
(4)反應原理中有碘單質的反應,可以選用淀粉作為指示劑;滴定終點判斷方法是:藍色消失,半分鐘保持不變,
故答案是:淀粉試液;藍色消失,半分鐘保持不變;
(5)有反應方程式:IO
3-+5I
-+6H
+→3I
2+3H
2O、I
2+2S
2O
32-═2I
-+S
4O
62-,可得關系式:IO
3-~3I
2~6S
2O
32-,試樣溶液10.00mL中:n(I)=n(IO
3-)=
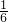
n(S
2O
32-)=
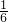
×0.0001 mol?L
-1×(20.80-10.00)×10
-3L=1.8×10
-7mol,10.000g食鹽含有的碘原子物質的量是10
-3L=1.8×10
-6mol,1000g食鹽中含有的碘原子的質量是:127×1.8×10
-6×100=22.86mg,多次操作取平均值可以減小誤差,
故答案是:22.86;多次實驗后取平均值;
(6)a、精確配制100mL食鹽溶液時,定容時仰視讀數,導致配制的溶液的體積偏大,溶液中溶質的濃度偏小,滴定時消耗的標準液偏少,測定結果偏低,故a錯誤;
b、精確配制100mL實驗溶液時,燒杯未洗滌并轉移洗液,配制的溶液溶質的物質的量減少,溶液中溶質的濃度偏小,滴定時消耗的標準液偏少,測定結果偏低,故b錯誤;
c、滴定過程中,滴定管漏液在錐形瓶外,消耗的標準液變大,測定結果偏高,故c正確;
d、滴定前,滴定管下端尖嘴處由氣泡,滴定后氣泡消失,導致消耗的標準液體積變大,測定結果偏高,故d正確;
故選cd.
分析:(1)根據題中反應原理及滴定過程判斷,還需要指示劑淀粉和碘化鉀溶液;
(2)注意稱量的質量是10.000g食鹽,必須使用電子天平,不能使用托盤天平;
(3)KIO
3與KI反應完全,碘化鉀溶液必須過量;根據滴定管的構造讀出體積,必須讀到0.01mL;
(4)反應原理設計了碘單質的反應,可以選用淀粉做指示劑;根據滴定終點的判斷方法完成;
(5)根據反應方程式找出關系式IO
3-~3I
2~6S
2O
32-,計算出IO
3-物質的量,就等于碘元素的物質的量,再計算出1kg食鹽中含有的碘的質量;減少實驗操作帶來的誤差,可以采用多次操作取平均值的方法;
(6)a、仰視讀數,配制的溶液體積偏大,濃度偏小;
b、燒杯未洗滌并轉移洗液,導致溶液中溶質的物質的量減小,配制的溶液濃度偏小;
c、滴定管漏液在錐形瓶外,消耗的標準液體積變大;
d、滴定前有氣泡,導致消耗的標準液體積變大.
點評:本題考查了測定食鹽中碘的含量方法,題量比較大,涉及了試劑選擇、儀器選擇、誤差分析、含量計算等知識,注意合理分析題中信息,根據所學知識完成,本題難度中等.

 加碘食鹽是在食鹽中添加碘酸鉀,當食鹽含碘量(以I計算)超過20~50mg/kg,將對人體造成危害,所以檢測食鹽含碘量是保障加碘食鹽質量的一項重要工作.某學生在實驗室測定食用精制鹽是否含碘及測定含碘量,主要反映為:
加碘食鹽是在食鹽中添加碘酸鉀,當食鹽含碘量(以I計算)超過20~50mg/kg,將對人體造成危害,所以檢測食鹽含碘量是保障加碘食鹽質量的一項重要工作.某學生在實驗室測定食用精制鹽是否含碘及測定含碘量,主要反映為: n(S2O32-)=
n(S2O32-)=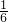 ×0.0001 mol?L-1×(20.80-10.00)×10-3L=1.8×10-7mol,10.000g食鹽含有的碘原子物質的量是10-3L=1.8×10-6mol,1000g食鹽中含有的碘原子的質量是:127×1.8×10-6×100=22.86mg,多次操作取平均值可以減小誤差,
×0.0001 mol?L-1×(20.80-10.00)×10-3L=1.8×10-7mol,10.000g食鹽含有的碘原子物質的量是10-3L=1.8×10-6mol,1000g食鹽中含有的碘原子的質量是:127×1.8×10-6×100=22.86mg,多次操作取平均值可以減小誤差,

 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案