
 Na2CO3+H2O+CO2↑,生成水、二氧化碳,導致質量減輕,根據差量法計算混合物中碳酸氫鈉的物質的量,生成的碳酸鈉的物質的量.根據n=
Na2CO3+H2O+CO2↑,生成水、二氧化碳,導致質量減輕,根據差量法計算混合物中碳酸氫鈉的物質的量,生成的碳酸鈉的物質的量.根據n=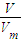 二氧化碳的物質的量,根據碳原子守恒計算加熱后碳酸鈉的物質的量,進而計算原混合物中碳酸鈉的物質的量,據此計算解答.
二氧化碳的物質的量,根據碳原子守恒計算加熱后碳酸鈉的物質的量,進而計算原混合物中碳酸鈉的物質的量,據此計算解答. Na2CO3+CO2↑+H2O↑ 固體質量減少
Na2CO3+CO2↑+H2O↑ 固體質量減少  =0.08mol,
=0.08mol,

 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、1:3 | B、2:3 | C、3:4 | D、4:5 |
查看答案和解析>>
科目:高中化學 來源:2010-2011學年江蘇省揚州中學高一(上)期中化學試卷(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com