
| A. | 上述兩個反應都是氧化還原反應,且轉移電子數相等 | |
| B. | Mn與Fe都屬于ⅤⅡ族元素 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-2(△H1+△H2) | |
| D. | 根據兩個反應可以看出,非自發反應加入合適的催化劑可以自發進行 |
分析 A.可根據O、H元素化合價的變化判斷;
B.Mn屬于ⅦB族,Fe屬于Ⅷ族元素;
C.依據蓋斯定律結合熱化學方程式計算分析所得到的熱化學方程式正誤;
D.催化劑只改變反應速率.
解答 解:A.MnFe2O4→MnFe2O4-x(s)+$\frac{x}{2}$O2(g)中,O元素化合價由-2價升高到0價轉移2x電子,MnFe2O4-x(s)+xH2O(g)═MnFe2O4(s)+xH2(g)中H元素化合價由+1價降低到0價,轉移2x電子,故A正確;
B.Mn屬于ⅦB族,Fe屬于Ⅷ族元素,故B錯誤;
C.①MnFe2O4(s)=MnFe2O(4-x)(s)+$\frac{x}{2}$O2(g);△H1 ②MnFe2O(4-x)(s)+xH2O(g)=MnFe2O4(s)+xH2(g);△H2
由熱化學方程式結合蓋斯定律,①+②得到xH2O(g)=xH2(g)+$\frac{x}{2}$O2 (g);△H=△H1+△H2,xH2(g)+$\frac{x}{2}$O2 (g)=xH2O(g)△H3=-(△H1+△H2),則2H2(g)+O2(g)=2H2O(g)△H=-$\frac{x}{2}$(△H1+△H2),故C錯誤;
D.催化劑只改變反應速率,不能決定反應能否進行,故D錯誤.
故選A.
點評 本題考查較為綜合,涉及化學反應能量變化分析判斷,蓋斯定律計算應用,元素守恒的計算等知識,為高頻考點,側重于學生的分析、計算能力的考查,題目難度較大.


 智趣寒假作業云南科技出版社系列答案
智趣寒假作業云南科技出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 四氯化碳電子式: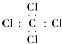 | |
| B. | 質子數35、中子數45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫離子結構示意圖: | |
| D. | HClO的結構式:H-Cl-O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | 實驗要求 | 答案 | 供選擇的化學試劑及方法 |
| a | 檢驗乙酸是否具有酸性 | A.新制的氫氧化銅懸濁液 | |
| b | 檢驗植物油中是否含有碳碳雙鍵 | B.紫色石蕊試液 | |
| c | 檢驗尿液中是否含有葡萄糖 | C.加入飽和Na2CO3溶液,分液 | |
| d | 除去乙酸乙酯中的少量乙酸 | D.溴水 |

 +4Na→
+4Na→ +2H2↑.
+2H2↑.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 酸銅粉末由無色變為藍色,生成的氣體從F頂端逸出,該氣體點燃后可燃燒.
酸銅粉末由無色變為藍色,生成的氣體從F頂端逸出,該氣體點燃后可燃燒.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗事實 | 理論解釋 |
| A | 稀硫酸能導電 | H2SO4為離子化合物 |
| B | HBr的酸性強于HCl的酸性 | Br的非金屬性比Cl強 |
| C | K3C60在熔融狀態下能夠導電 | K3C60中含有離子鍵 |
| D | HF的沸點高于HCl | F的非金屬性比Cl強 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將煤粉碎,增大固體的表面積可以有效加快煤燃燒的速率 | |
| B. | 空氣過量有利于煤充分燃燒,因此鼓入空氣的量越多約好 | |
| C. | 可以用在煤中加入生石灰,減少SO2氣體的排放 | |
| D. | 煤的氣化可以使煤發生化學反應轉化為水煤氣等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com