
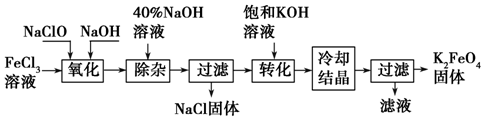
分析 氯化鐵溶液、次氯酸鈉溶液和氫氧化鈉溶液混合發生氧化還原反應生成高鐵酸鈉、氯化鈉和水,加入40%的氫氧化鈉溶液除雜,過濾得到氯化鈉固體和濾液,濾液中加入氫氧化鉀溶液實現高鐵酸鈉轉化為高鐵酸鉀沉淀,冷卻結晶過濾得到高鐵酸鉀固體;
(1)反應中NaClO是氧化劑,還原產物是NaCl,根據元素守恒,可知反應式中需要補充NaCl和H2O.根據化合價升降法配平方程式.
(2)由工藝流程可知,“氧化”過程除雜后的濾液中含有Na2FeO4,“轉化”過程的產物為K2FeO4,故“轉化”過程是在加入KOH溶液后,將Na2FeO4轉化為溶解度更小的K2FeO4.
(3)由題目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在堿性溶液中穩定,在分離提純的時候就要在堿性環境中進行,要防止引入新雜質,所以需要將K2FeO4粗產品在稀KOH溶液中溶解,然后加入飽和KOH溶液,冷卻結晶.
解答 解:(1)反應中FeCl3→Na2FeO4,鐵元素化合價由+3價升高為+6價,化合價總升高3價,NaClO→NaCl,氯元素化合價由+1降低為-1價,化合價總共降低2價,化合價升降最小公倍數為6,故FeCl3系數為2,NaClO系數為3,由鐵元素守恒可知 Na2FeO4系數為2,由氯元素守恒可知NaCl系數為2×3+3=9,根據鈉元素守恒可知NaOH系數為9+2×2-3=10,由氫元素守恒可知H2O系數為5,配平方程式為2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;
反應中NaClO→NaCl,氯元素化合價由+1降低為-1價,NaClO是氧化劑,
故答案為:2;10;3;2;9NaCl;5H2O;NaClO;
(2)“轉化”過程是在加入KOH溶液后,將Na2FeO4轉化為溶解度更小的K2FeO4,反應方程式為Na2FeO4+2KOH=K2FeO4+2NaOH;
故答案為:Na2FeO4+2KOH=K2FeO4+2NaOH;
(3)由題目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在堿性溶液中穩定,在分離提純的時候就要在堿性環境中進行,要防止引入新雜質,所以需要將K2FeO4粗產品在稀KOH溶液中溶解,然后加入飽和KOH溶液,冷卻結晶,過濾.
故答案為:稀KOH溶液;再加入飽和KOH溶液,冷卻結晶,過濾.
點評 本題考查方程式的書寫、基本的實驗操作、閱讀題目獲取信息能力等,難度中等,需要學生具備綜合運用知識及題目信息分析問題、解決問題能力.對于這類題目,需要搞清楚每一步反應物、生成物,清楚工藝流程原理.


科目:高中化學 來源: 題型:解答題
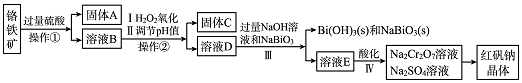
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ |
 ;元素⑨形成的氫化物的電子式
;元素⑨形成的氫化物的電子式 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
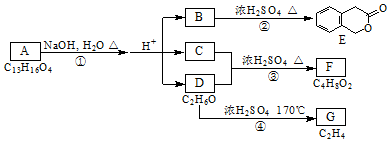
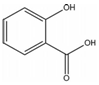 ,其名稱為:鄰羥基苯甲酸
,其名稱為:鄰羥基苯甲酸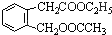 ④反應的反應類型是消去反應
④反應的反應類型是消去反應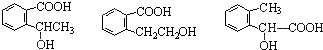 任意一個
任意一個 或CH2=CH2+H2O$\stackrel{催化劑}{→}$CH3CH2OH.
或CH2=CH2+H2O$\stackrel{催化劑}{→}$CH3CH2OH.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 非金屬原子間以共價鍵結合的物質一定是共價化合物 | |
| B. | 含有共價鍵的化合物一定是共價化合物 | |
| C. | 凡是能電離出離子的化合物一定是離子化合物 | |
| D. | 凡是含有離子鍵的化合物一定是離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將AlCl3溶液和Al2(SO4)3溶液分別加熱、蒸干、灼燒,所得固體成分相同 | |
| B. | 配制FeSO4溶液時,將FeSO4固體溶于稀鹽酸中,然后稀釋至所需濃度 | |
| C. | 用加熱的方法可以除去KCl溶液中的Fe3+ | |
| D. | 鍋爐中沉積的CaSO4可用Na2CO3溶液浸泡后,再將不溶物用稀鹽酸溶解去除 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 化學式 | 電離常數 |
| CH3COOH | K=1.7×10-5 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、CN- | B. | HCO3-、CH3COOH、CN-、CO32- | ||
| C. | HCN、HCO3-、CN-、CO32- | D. | HCN、HCO3-、CH3COO-、CN- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
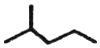 ②甲苯 ③ClCH=CHCl ④
②甲苯 ③ClCH=CHCl ④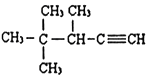
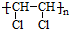
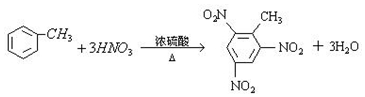 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com