
| A. | 已知H2的燃燒熱△H=-285.8 kJ•mol-1,則用熱化學方程式可表示為:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 稀硫酸和Ba(OH)2溶液的反應:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NH4HCO3溶液與足量NaOH溶液共熱:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | 用足量KMnO4溶液吸收SO2氣體:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ |
分析 A.燃燒熱生成物質為穩定的氧化物;
B.離子個數配比不符合物質結構組成;
C.氫氧化鈉足量,銨根離子、碳酸氫根離子都反應;
D.二者發生氧化還原反應,生成硫酸根離子、二價錳離子和水.
解答 解:A.氫氣燃燒生成液體水穩定,而H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1,故A錯誤;
B.稀硫酸和Ba(OH)2溶液的反應,離子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故B錯誤;
C.NH4HCO3溶液與足量NaOH溶液共熱,離子方程式:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,故C錯誤;
D.用足量KMnO4溶液吸收SO2氣體,離子方程式:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,故D正確;
故選:D.
點評 本題考查離子反應及化學反應的書寫,為高頻考點,把握發生的化學反應為解答的關鍵,側重考查復分解反應、氧化還原反應離子方程式書寫,注意燃燒熱的概念,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年河北省高一上10月月考化學試卷(解析版) 題型:選擇題
以下是對某水溶液進行離子檢驗的方法和結論,其中正確的是
A.先加入BaCl2溶液,再加入足量HNO3溶液,產生白色沉淀,溶液中一定含有大量SO42-
B.加入足量的CaCl2溶液,產生了白色沉淀。溶液中一定含有大量的CO32-
C.加入足量濃 NaOH溶液,產生帶有強烈刺激性氣味的氣體,溶液中一定含有大量NH4+
D.先加適量鹽酸將溶液酸化,再加AgNO3溶液,產生白色沉淀,溶液中一定含有大量Cl-
查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省高二上第一次學段考試化學卷(解析版) 題型:選擇題
海洋中有豐富的食品、礦產、能源、藥物和水產資源,下圖為海水利用的部分過程。
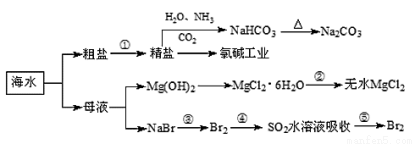
下列有關說法正確的是( )
A.在第③、④、⑤步驟中,溴元素均被氧化
B.制取NaHCO3的反應是利用其在此反應所涉及物質中溶解度最小
C.用澄清的石灰水可鑒別NaHCO3和Na2CO3
D.工業上通過電解飽和MgCl2溶液制取金屬鎂
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗 序號 | 反應溫度 (℃) | 參加反應的物質 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①⑤⑦ | B. | ③④⑥ | C. | ②④⑤ | D. | ②③⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
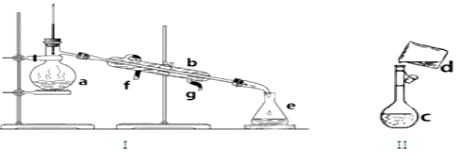
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

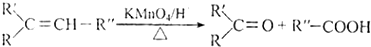
 .
.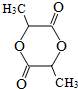 .
.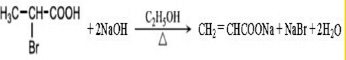 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 凡是放熱反應都是自發的,凡是吸熱反應都是非自發的 | |
| B. | 自發反應一定是放熱反應,非自發反應一定是吸熱反應 | |
| C. | 自發反應在恰當條件下才能實現 | |
| D. | 自發反應在任何條件下都能實現 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
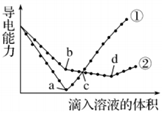
| A. | b點,水電離產生的c(H+)<10-7mol/L | B. | ①代表滴加H2SO4溶液的變化曲線 | ||
| C. | a、d兩點對應的溶液均顯中性 | D. | c點,兩溶液中含有相同量的 OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com