
【題目】下列屬于堿性氧化物的是
A. SO2 B. CaO C. CO D. Cu2(OH)2CO3
 華東師大版一課一練系列答案
華東師大版一課一練系列答案科目:高中化學 來源: 題型:
【題目】下面是一些晶體的結構示意圖。
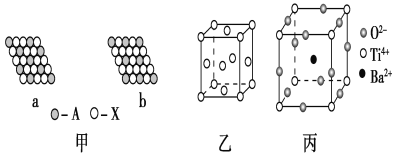
(1)下列關于晶體的說法正確的是________(填字母)。
A.晶體的形成與晶體的自范性有關
B.可以用X射線衍射儀區分晶體和非晶體
C.石蠟是非晶體,但有固定的熔點
D.晶胞就是晶體
(2)圖甲表示的是晶體的二維平面示意圖,a、b中可表示化學式為AX3的化合物的是________。(填“a”或“b”)
(3)圖乙表示的是金屬銅的晶胞,請完成以下各題:
①該晶胞“實際”擁有的銅原子數是________,銅原子的配位數為________。
②該晶胞稱為________(填字母)。
A.六方晶胞
B.體心立方晶胞
C.面心立方晶胞
(4)圖丙為鈦酸鋇晶體的晶胞結構,該晶體經X射線分析得出,重復單位為立方體,頂點位置被Ti4+所占據,體心位置被Ba2+所占據,棱心位置被O2-所占據。
①寫出該晶體的化學式:_____________________________。
②若將Ti4+置于晶胞的體心,Ba2+置于晶胞頂點,則O2-處于立方體的________位置。
③Ti4+的氧配位數和Ba2+的氧配位數分別為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值。下列說法正確的是
A. 標準狀況下,2.24L SO3中含有的氧原子數目為0.3NA
B. 18gH218O和2H2O的混合物中,所含中子數為10NA
C. 一定條件下,2.3g的金屬鈉完全與氧氣反應時生成3.6g產物時失去的電子數為0.1NA
D. 物質的量濃度為0.1molL﹣1的MgCl2溶液中,含有Cl﹣個數為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列各化合物:
A.CH3CH2CH2CHO與CH3COCH2CH3
B.CH3CH(NH2)COOH與H2NCH2COOH
C. ![]() 與
與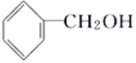
D.CH3CH2C≡CH與CH2=CH-CH=CH2
E.HOOCCH2CH2COOH與HOOC-COOH
F.戊烯與環戊烷
已知:![]()
 。
。
(1)上述各組化合物中屬于同系物的是________,屬于同分異構體的是________(填字母)。
(2)上述化合物中的含氧官能團是_____________________(寫名稱)。根據官能團的特點可將C中兩種化合物劃分為________類和________類。
(3)若將A中兩化合物看作是某單烯烴被酸性高錳酸鉀溶液氧化生成的,則單烯烴的結構簡式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯是海水中含量最豐富的元素,氯的單質及其化合物在生成、生活領域應用廣泛。
(1)自來水廠常用液氯進行殺菌消毒。氯氣溶于水發生的可逆反應為______________(用離子方程式表示)。
(2)用液氯消毒會產生微量有機氯代物,危害人體健康,可以使用二氧化氯(ClO2)代替液氯。工業上以黃鐵礦(FeS2)、氯酸鈉(NaClO3)和硫酸溶液混合制備二氧化氯氣體。已知黃鐵礦中的硫元素(-1價)最終氧化成SO42-,寫出制備二氧化氯的離子方程式_____________________________________。
(3)生產漂白粉工廠的主要設備是氯化塔,塔從上到下分為四層,如圖為生產流程示意圖。
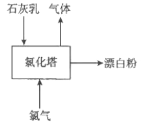
生產漂白粉反應的化學方程式為_____________________。實際生產中,將石灰乳(含有3%-6%水分的熟石灰)從塔頂噴灑而下,氯氣從塔的最底層通入。這樣加料的目的是_____________________________。
(4)用莫爾法可以測定溶液中Cl-的含量。莫爾法是一種沉淀滴定法,用標準AgNO3溶液滴定待測液,以K2CrO4為指示劑,滴定終點的現象是溶液中出現磚紅色沉淀(Ag2CrO4)。已知平衡Cr2O72-+H2O![]() 2CrO42-+2H+,該滴定過程需要控制pH范圍在6.5~10.5,若pH小于6.5會使測定結果偏高。結合平衡移動原理解釋偏高的原因:_______________________________ 。
2CrO42-+2H+,該滴定過程需要控制pH范圍在6.5~10.5,若pH小于6.5會使測定結果偏高。結合平衡移動原理解釋偏高的原因:_______________________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯堿工業是最基本的化學工業之一,其產品用途廣泛。
(1)寫出氯堿工業電解食鹽水的離子方程式____________。
(2)①圖1是氯堿工業中陽離子交換膜電解槽示意圖(“陽離子交換膜”特性是只允許陽離子通過而阻止陰離子和氣體通過)。
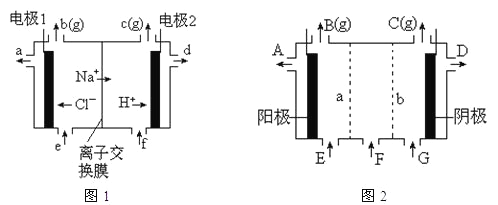
圖1中電極1應連接電源的__極(填“正”或“負”極);理論上講,從f口加入純水即可,但實際生產中,純水中要加入一定量的NaOH溶液,其原因是_____。
②圖2是根據氯堿工業中離子交換膜技術原理,設計的電解Na2SO4溶液生產NaOH和H2SO4溶液的裝置。其中a、b處均設有離子交換膜,則a處為__(填“陽”、“陰”)離子交換膜。陽極的電極反應式是___。從D口流出的物質為____。
(3)某同學采用如下裝置對氯堿工業中電解食鹽水的條件進行探究,記錄如下:
裝置 | 編號 | 條件控制 | 測定結果 | ||||
電極材料 | 溶液濃度 | 溫度/℃ | *電解電壓/V | 氣體V陰:V陽 | |||
陰極 | 陽極 | ||||||
| I | C | C | 1 mol/L | 25 | 8 | >1:1 |
II | 飽和 | 25 | 5 | ≈1:1 | |||
III | 飽和 | 50 | 4 | ≈1:1 | |||
IV | Fe | C | 飽和 | 50 | 3.5 | ≈1:1 | |
電解電壓:開始發生電解反應時的電壓
①對比實驗I和Ⅱ陰、陽極氣體體積比,推測實驗I陽極可能有其它氣體生成,其它氣體的化學式為_____。
②資料顯示:“較低的電解電壓有利于節能降耗……”。結合上表中Ⅲ和Ⅳ的數據,解釋Ⅳ更有利于節能降耗的原因_______________。
(4)資料顯示“氯堿工業中采用金屬陽極材料,可以降低電解電壓,實現節能降耗”,該同學用50℃的飽和NaCl溶液進行實驗驗證,結果如下:
裝置 | 編號 | 電極材料 | 電解 電壓/V | 現象 | |
陰極 | 陽極 | ||||
| V | Fe | Fe | 1.5 | 陰極:產生無色氣體 U形管底部:有白色沉淀生成 |
VI | Fe | Cu | 2 | 陰極:產生無色氣體 陽極:有白色膠狀沉淀生成且逐漸增多 U形管底部:靠近陰極區白色膠狀沉淀逐漸轉化為淡黃色,最后變成磚紅色 | |
實驗V中,通過檢驗陰、陽極附近溶液所含離子,推斷產生白色沉淀為Fe(OH)2 。該同學經查閱資料分析認為:“實驗VI中白色沉淀是CuCl,淡黃色沉淀是CuOH。
i.陽極生成CuCl的電極反應式為_________。
ii.用化學用語和必要文字解釋陰極區白色膠狀沉淀轉化為淡黃色的原因___________。
該同學通過以上探究認為,氯堿工業中不能采用Fe、Cu作陽極材料。
(5)綜合以上探究,你對氯堿工業中電解食鹽水條件控制的建議有 _____(至少寫出兩條)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com